发布日期:2018-10-08 13:59 来源:活性炭网 作者:活性炭网 浏览数:
本研究报道了从含有H3PO4的杏石(ASAC)制备活性炭及其从水溶液中除去纺织工业中使用的考马斯蓝(CB)的能力。 FTIR光谱用于获得吸附剂和CB之间相互作用的信息。 在搅拌的批量吸附器
本研究报道了从含有H3PO4的杏石(ASAC)制备活性炭及其从水溶液中除去纺织工业中使用的考马斯蓝(CB)的能力。FTIR光谱用于获得吸附剂和CB之间相互作用的信息。在搅拌的批量吸附器中进行一系列接触时间实验以评估系统变量的影响。讨论了结果并表明ASAC可用于废水处理。两种模型对总吸附速率的比较表明,拟二级模型更好地描述了吸附动力学。测定CB在ASAC上的吸附等温线并与常用的等温线方程相关联。Freundlich模型获得的较小RMSE值表明曲线拟合更好; 发现CB的单层吸附容量在温度22.5℃时为10.09mg / g,在温度50℃和pH~2时为98.022mg / g。热力学参数表明吸附过程的自发和放热性质。熵的正值(ΔS)清楚地表明在CB吸附到ASAC期间固溶界面处的随机性降低,表明在吸附剂的活性位点和离子之间可能发生一些结构交换。活化能(66.161kJ / mol)表明化学吸附是主要的。熵的正值(ΔS)清楚地表明在CB吸附到ASAC期间固溶界面处的随机性降低,表明在吸附剂的活性位点和离子之间可能发生一些结构交换。活化能(66.161kJ / mol)表明化学吸附是主要的。熵的正值(ΔS)清楚地表明在CB吸附到ASAC期间固溶界面处的随机性降低,表明在吸附剂的活性位点和离子之间可能发生一些结构交换。活化能(66.161kJ / mol)表明化学吸附是主要的。
关键词:杏石; 考马斯蓝G-250; 动力学; 等温线; 热力学
染料的生产厂房和许多其它工业,其利用染料全局由一天进步技术[增加1 - 3 ]。纺织,皮革,纸张,塑料,食品,化妆品等是这些行业中的一部分。目前,据估计,不同的商业染料和颜料的约100000存在和超过7.105音调全世界每年生产的[ 4,5 ]。其结果是,由染料的水体污染已成为主要污染源之一拥有约40000每年释放到环境中的染料色调[ 5,6 ]。此外,大多数染料耐热和耐光,不可生物降解[ 5]。它们在废水中的存在通过降低光穿透和光合作用导致水污染[ 3 ]。因此,从废水中去除染料已变得对环境有重要意义。各种处理已经研究并发现是有效降低像化学氧化,生物处理,凝结-絮凝,膜工艺,吸附等废水染料浓度[ 7,8 ]。在这些方法中,将吸附到活性碳上已经发现是优越的,廉价的和有效的废水[治疗许多染料5,7,8]。活性炭的高吸附能力是由于高表面积,颗粒内部的大量孔隙,以及存在许多不同类型的表面官能团[ 5 ]。然而,商业中可用的活性炭相对昂贵; 它们的生产和再生成本可能构成其限制因素[ 6 ]。因此,全世界大多数研究人员都把重点放在寻找新的低成本前体上,特别是农业废弃物。来自废物和农业副产品的前体如白云石[ 8 ],枣石[ 9 ],废竹脚手架[ 5 ],麦麸[ 10 ],甘蔗渣[ 7 ]和华丽的豆荚[ 11 ]显示出很大的吸收潜力。本研究的目的是使用杏石作为低成本前体,因为阿尔及利亚的农业每年产生超过20,000克的杏石,并且代表了大量的固体污染物。该研究的目的是评估从杏石中制备的活性炭去除考马斯蓝(G-250)的能力,考马斯蓝是一种主要用于纺织工业的酸性染料,以及用于染色蛋白质的生物和生物化学[ 12]。]。进行该研究的目的是优化从水溶液中最大程度地除去该染料的条件。除此之外,将平衡吸附数据拟合到各种模型以获得与吸附过程相关的常数。最后,进行热力学和动力学研究以估计与活化能平行的吸附速率以及自由能,焓和熵的变化。
材料和方法
在所有实验中使用分析级试剂。酸性染料,CB(99%)购自Merck Company。CB的化学结构和性质列于表1中。从阿尔及利亚Boumerdes地区获得的杏石经风干,粉碎和筛分,得到两个几何平均尺寸为63-2.5mm的部分。将100g所选部分用浓H 3 PO 4浸渍(85%)并在空气中干燥。然后,在250℃(4小时)的热空气烘箱中活化。用蒸馏水洗涤碳化材料以除去游离酸直至pH达到6.8并在105℃下干燥。将清洁的生物质机械研磨并筛分以得到不同粒度的粉末:<63,[63-80],[80-100],[100-200],[200-315],[315-800]μm和[0.8-1],[1-1.6],[1.6-2] mm。表2给出了杏石活性炭(ASAC)的物理和化学性质。
| 野蛮公式 | C 47 H 49 N 3 NaO 7 S 2 |
|---|---|
| 分子量 | (855.028±0.054)g / mol |
| 密度 | (0.96±0.05)g / mL |
| 波数(λmax) | 595纳米 |
| 折射率 | (1.334±0.124) |
| 名称 | 考马斯亮蓝(G-250) |
表1:酸性染料,考马斯蓝(G-250)的化学性质
| 元素分析(%) | |
|---|---|
| C | 48.45 |
| H | 6.03 |
| ñ | 0.44 |
| Ø | 45.08 |
| pHzpc | (7.05±0.10) |
| 表面积(m 2 / g) | (88.05±1.03) |
| 平均孔径(Ẳ) | (176.32±0.25) |
| 平均孔容(mL / g) | (0.2641±0.003) |
| 电导率(μS/ cm) | (112.0±2) |
| 湿度(%) | (1.48±0.16) |
| 灰分率(%) | (1.68±0.02) |
| 有机物百分比(%) | (98.32±0.11) |
表2:杏石活性炭(ASAC)的物理和化学性质。
批量模式吸附研究
初始CB浓度(10-100 mg / L),pH(2-10),吸附剂用量(1-7 g / L)和温度(295-329 K)等实验参数对吸附去除的影响以分批操作模式研究CB离子的特定接触时间段(0-60分钟)。通过将精确量的CB(99%)溶解在蒸馏水中制备CB溶液,将其用作储备溶液并稀释至所需的初始浓度。用0.1mol / L HCl或0.1mol / L NaOH调节pH。对于动力学研究,将所需量的ASA与Erlenmeyer烧瓶中的10mL BC溶液接触。然后,将烧瓶以300rpm放置在旋转振荡器上,并以规则的时间间隔取样并以3000rpm离心10分钟。在Perkin Elmer紫外 - 可见分光光度计550S型号上在波长595nm下用分光光度法测量上清液中的CB含量。活性炭吸附的CB离子量qt(mg / g)通过使用以下等式(A1)计算:
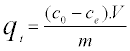 (A1)
(A1)
其中C o是初始CB浓度,C t是任何时间的CB浓度(mg / L),V是溶液的体积(L),m是活性炭的质量(g)。
由于等温线和动力学模型的线性化导致的固有偏差,非线性回归均方根误差(RMSE)测试被用作拟合质量的标准[ 13 ]。
通过以下等式(A2)评估模型的RMSE:
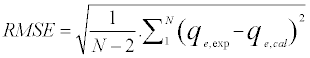 (A2)
(A2)
其中,q e(exp)(mg / g)是摄取的实验值,q e(cal)是使用模型计算的摄取值(mg / g),N是实验中观察的数量(数量)数据点)。RMSE值越小,曲线拟合越好[ 13 ]。
傅立叶变换红外(FTIR)分光光度计用于鉴定吸附到ASAC上的特征官能团。将5mg ASAC与干光谱KBr混合。将混合物充分混合并在4500psi的压力下压制以形成KBr薄盘。然后,用Perkin Elmer 2000红外光谱仪绘制IR光谱。将样品从4000-400cm-1扫描16次以增加信噪比。
通过使用PW 1890型的Philips X射线衍射仪获得Native Apricot Stone(NAS)和ASAC的X射线衍射(XRD)图案。从具有铜靶(40kV,40mA,λ= 1.54)的管产生X射线。用CONIT T-2T扫描模式以0.17度/步宽和8度/分钟的扫描速度获得光谱。
为了观察制备的ASAC在吸附CB离子之前和之后的表面结构,使用扫描电子显微镜(JOEL-5910)以不同的分辨率拍摄扫描电子显微照片。
比表面积(A)在Micromeritics ASAP2010M容量吸附分析仪上在77K下测定。在测量之前将样品在573K真空下脱气过夜。
通过红外光谱分析进行结构表征
ASAC的傅里叶变换红外(FTIR)光谱如图1所示。吸附剂的FTIR光谱显示出许多吸收峰,表明吸附剂中存在许多官能团。在3436,2929,1732,1599和1508cm -1处观察到峰位置。在3122-3680cm-1之间的区域中的带与羟基(-OH)基团(libber和分子间氢带)相关。2929和1508 cm -1处的谱带表明存在(-CH2)基团(对称和反对称),而1600-1665 cm -1区域的谱带表明存在基团(CH,-C = Cand C = C) )。峰值在1732 cm -1在羧基中指定为C = O. 这些结果清楚地表明,包括羧基和羟基的官能团有助于吸附酸性染料离子的结合。
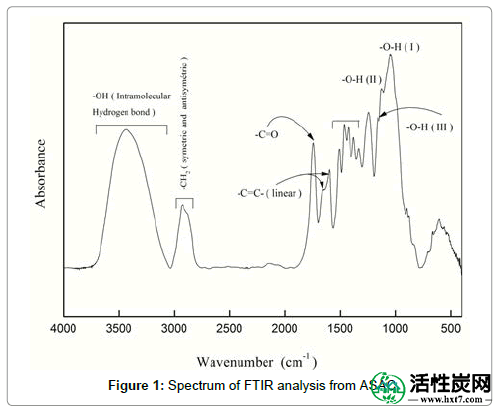
图1: ASAC的FTIR分析谱
准备ASAC的特征:
表2总结了ASAC的物理和化学性质以及元素分析。(NAS)和制备的ASAC的XRD图谱分别显示在图2a和2b中。从ASAC模式可以得出结论,没有确定的XRD峰,表明ASAC主要是无定形的。
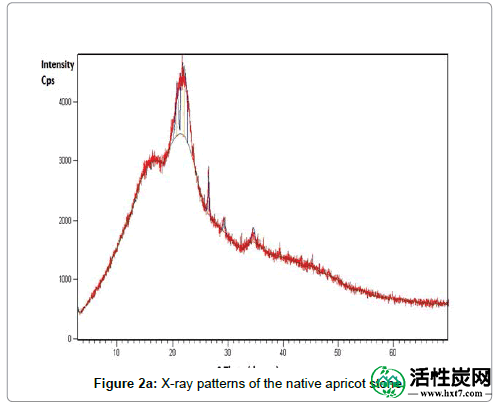
图2a:天然杏石的X射线图案。
图2b:杏石活性炭的X射线图案。
制备的ASAC的扫描电子显微镜(SEM)分析:
吸附前后ASAC的SEM显微照片分别如图3a和3b所示。制备的ASAC呈现出具有不同孔径的微孔结构。此外,ASAC表面似乎是粗糙的并且在吸附之前呈现许多突起。吸附后,ASAC形态发生变化,表面变得更光滑,孔隙更少,表明在表面和孔隙内都有吸附。

图3a:吸附前ASAC的扫描电子显微照片。

图3b:吸附后ASAC的扫描电子显微照片。
分析参数的影响
ASAC尺寸的影响:在ASAC的分批吸附实验的第一阶段,研究了粒度对ASAC对酸性染料吸附的影响。在不同的颗粒尺寸下观察到吸收容量和去除效率的显着变化,表明在较低的颗粒尺寸(315-800μm)下获得了最佳性能。通常,较小的颗粒提供大的表面积,导致高的酸性染料吸收能力和去除效率。随后将范围(315-800μm)用于所有吸附实验(图4)。
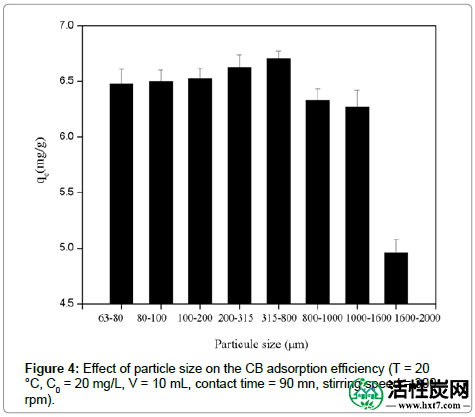
图4:粒度对CB吸附效率的影响(T = 20℃,C0 = 20mg / L,V = 10mL,接触时间= 90nm,搅拌速度= 300rpm)。
pH的影响: CB溶液的pH在吸附过程中起重要作用。很明显,酸性染料去除的百分比随pH的降低而增加(图5)。pH对ASAC吸附的影响可以基于零电荷pH(zpc)的点来解释,其中吸附剂表面是中性的。当介质pH低于pH(zpc)值时,吸附剂的表面电荷为正,而pH值超过pH(zpc)则为负值[ 14]]。因此,由于静电引力,CB阴离子的吸附是有利的。实际上,CB分子呈现不同的带电状态,对应于存在的三个氮原子处的正电荷量,而两个磺酸基团通常总是带负电荷。在pH 2以上,只有一个氮原子带正电荷,染料分子是蓝色阴离子,总电荷为-1。
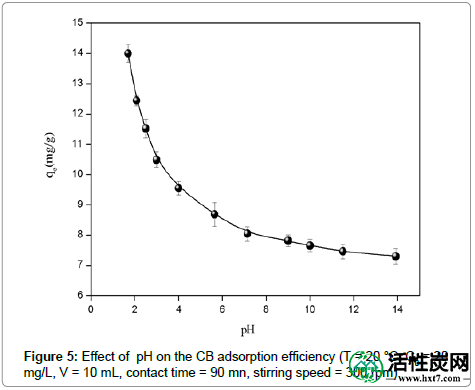
图5: pH对CB吸附效率的影响(T = 20℃,C0 = 20mg / L,V = 10mL,接触时间= 90nm,搅拌速度= 300rpm)。
ASAC的pH(zpc)为7.05(图6),并且在较高pH下ASAC的表面电荷为负。随着pH降低,带正电荷的位点的数量增加并且有利于静电吸引物吸附CB阴离子。Demirbas [ 15 ] 报道了类似的实验细节。
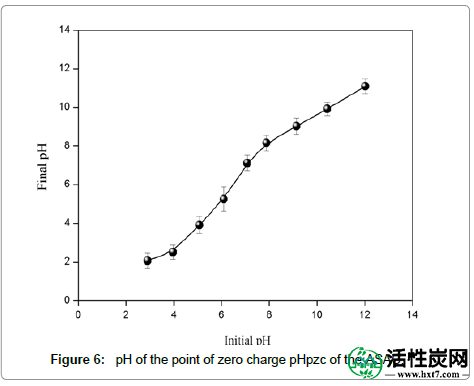
图6: ASAC的零电荷pHpzc点的pH。
搅拌速度的影响:还研究了搅拌速度对ASA吸附的影响。对于300rpm的速度获得最大吸附(图7)。这种中等速度为混合物悬浮液提供了最佳的均匀性。在高速下,发生涡流现象并且悬浮液不再是均匀的,这使得CB离子的吸附变得困难。
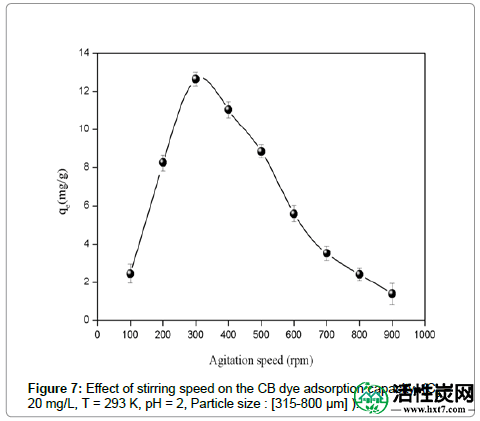
图7:搅拌速度对CB染料吸附容量的影响(C0 = 20mg / L,T = 293K,pH = 2,粒径:[315-800μm])。
接触时间和初始浓度的影响: CB的吸附容量随时间增加,并在55分钟后达到最大值,此后,它达到恒定值,表明不再从溶液中除去CB离子。平衡时间为60分钟。因此,将酸性染料的初始浓度从10mg / L改变为100mg / L,吸附量从8.09增加到66.17mg / g(图8)。这可归因于随着初始酸性染料浓度的增加,浓度梯度的驱动力增加,以克服水相和固相之间的CB离子的传质阻力。
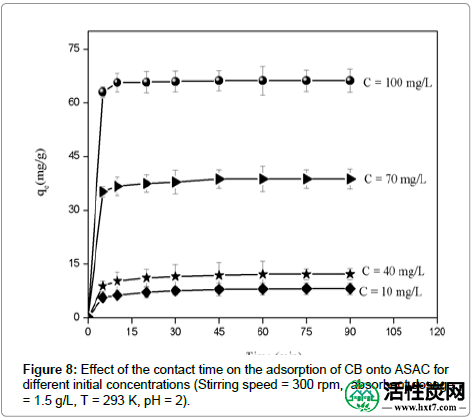
图8:对于不同的初始浓度,接触时间对CB吸附到ASAC上的影响(搅拌速度= 300rpm,吸收剂量= 1.5g / L,T = 293K,pH = 2)。
吸附剂用量的影响:对于ASAC的第一阶段吸附实验,研究了吸附剂用量对ASAC酸性染料吸附的影响。在不同的吸附剂用量(1至7 g / L)下观察到吸收能力和去除效率的显着变化表明,当吸附剂用量为7 g / L时,获得了最佳性能(图9)),这个结果是预期的,因为通常可以获得更多的质量,更多的接触表面提供吸附,从而提高了去除效率。此外,溶液中较高剂量的吸附剂,离子的可交换位点的更大可用性,即更有活性的位点可用于CB离子的结合。我们的结果与文献中的结果在定性上很好地吻合。该结果随后用于所有等温吸附实验。
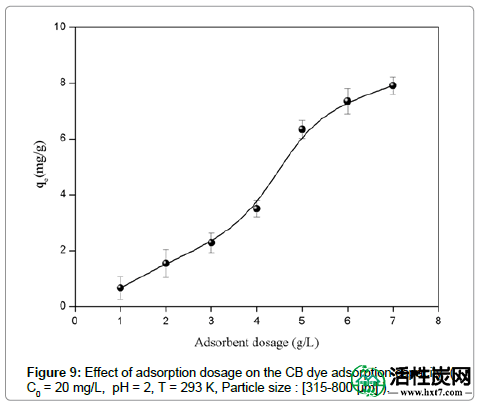
图9:吸附剂量对CB染料吸附容量的影响(C0 = 20mg / L,pH = 2,T = 293K,粒径:[315-800μm])。
吸附等温线:等温线的形状是诊断特定吸附现象性质的第一个实验工具。等温线已根据Giles等人进行分类。[ 16 ]分为四个主要类别:L,S,H和C.根据上述分类,ASAC在不同温度(22.5°C和50°C)下的等温线显示L型曲线(图10))。L曲线的初始部分表明在低浓度下酸性染料和载体之间的小的相互作用。然而,随着液相中的浓度增加,更容易发生吸附。这种行为是由于协同效应,吸附的分子由于吸附物吸附物的吸引作用而促进了附加分子的吸附。Langmuir [ 17 ]和Freundlich模型[ 18 ] 描述了吸附剂和吸附质之间的平衡关系,并通过评估统计RMSE值来比较对吸附研究的适用性。Langmuir和Freundlich等温线的线性形式由以下等式(B1)和(B2)表示:
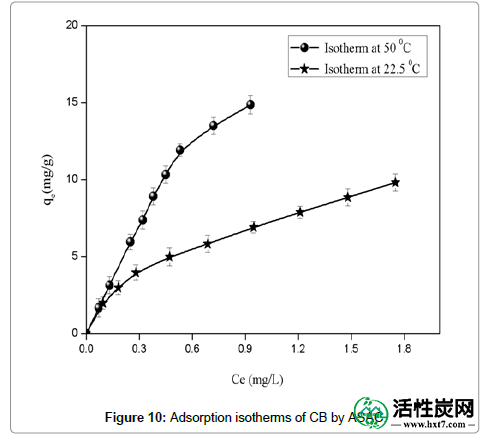
图10: ASAC对CB的吸附等温线。
 (B1)
(B1)
其中C e是平衡浓度(mg / L),q max是单层吸附容量(mg / g),K L是与自由吸附能量相关的常数(Langmuir常数,L / mg)。
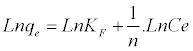 (B2)
(B2)
常数K F表示吸附剂的吸附容量(L / g),n是与吸附驱动力的大小有关的经验常数。对于两个温度(22.5和50℃),CB的Langmuir和Freundlich等温线的线性化形式和理论参数以及回归系数列于表3中。Freundlich模型获得的较小RMSE值表明更好的曲线拟合。吸附的有利性质可以用平衡参数的无量纲分离因子表示,其由等式(B3)[ 19 ]定义:
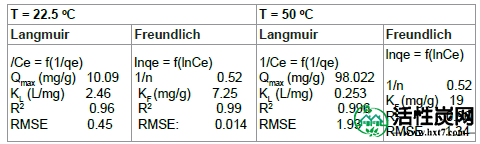
表3: Langmuir和Freundlich模型的吸附等温线系数
 (B3)
(B3)
其中K L是Langmuir常数,Co是吸附质在溶液中的初始浓度。R L的值表示等温线的类型:不可逆(R L = 0),有利(0 <R L <1),线性(R L = 1)或不利(R L > 1)。在该研究中,R L值小于1,证实在两种情况下吸附过程都是有利的,并且Langmuir等温线的适用性也是如此。
吸附动力学:动力学研究对吸附过程很重要,它描述了吸附物的吸收速率并控制了整个吸附过程的剩余时间。本研究选择两个动力学模型,即伪一阶和伪二阶来描述吸附。伪一阶方程[ 20 ]在等式(C1)中给出:
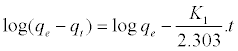 (C1)
(C1)
伪二阶模型[ 21,22 ]由等式(C2)表示:
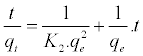 (C2)
(C2)
其中qt(mg / g)是在不同时间t(min)吸附在吸附剂上的金属量,K 1是假一级动力学的速率常数(min -1),K 2是伪秒的速率常数订购动力学(g / mg min)。
表4总结了ASAC的速率常数,预测上采样和相关系数。对于伪一阶动力学,实验数据与线性有很大偏差。这可以通过q e和相关系数的低值来证明。因此,伪一阶模型不适用于该系统。伪二级动力学模型的相关系数和q e,cal与实验结果非常一致(表4)。
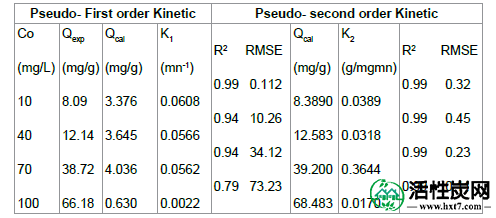
表4: CB离子吸附到ASAC上的动力学参数
温度的影响:酸性染料BC吸附到ASAC上的活化能(Ea)由Arrhenius方程(D1)计算[ 23 ]。
 (D1)
(D1)
速率常数k(表5)随着温度的升高而增加,表明在高温下吸附是有利的,其中R是气体常数(8.314J / K.mol),T是温度(K)。活化能(66.161kJ / mol)由lnk对1 / T曲线的斜率计算(图11)。在范围温度研究中计算热力学参数并在表6中给出。
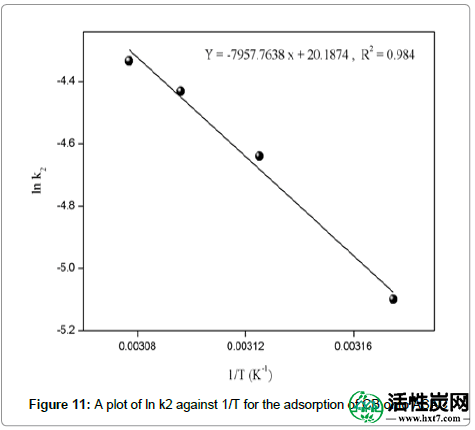
图11:将CB吸附到ASAC上的ln k2对1 / T的图
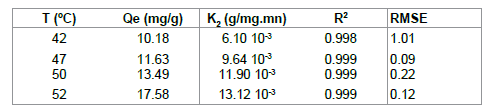
表5:不同温度下的速率常数k 2
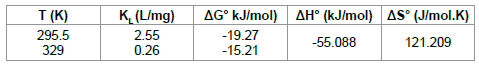
表6: ASAC上CB吸附的热力学参数
制备的ASAC的性能:为了对制备的ASAC的效率有所了解,表7中报告了该工作的酸性染料吸附与其他相关研究的比较。吸附剂q max的吸附容量是用于比较的参数。可以得出结论,q max的值与大多数先前的工作的值非常一致,这表明CB可以很容易地吸附在本工作中使用的ASAC上。这表明在阿尔及利亚非常丰富的杏石是CB的廉价且有效的吸附剂。
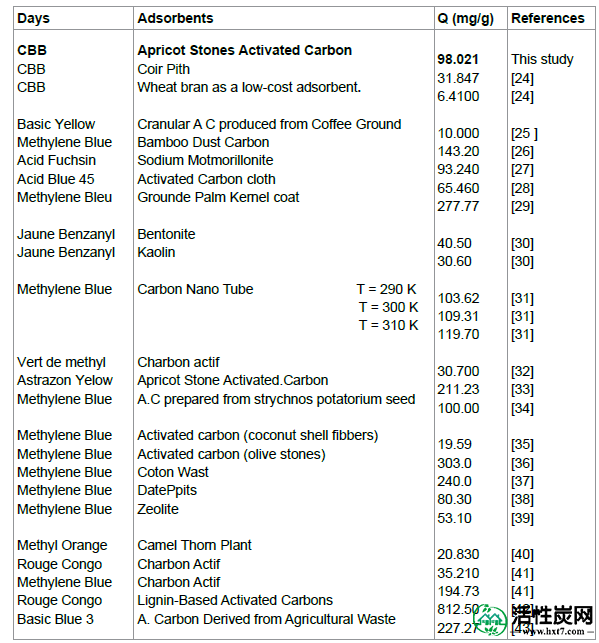
表7: ASAC性能与先前研究的前体的比较
该研究表明,由杏石制备的活性炭可用作从水溶液中除去考马斯蓝的有效吸附剂。与Langmuir等温线相比,Freundlich等温线模型提供了更好的平衡吸附数据拟合。在22.5℃的温度下,其最大吸附容量为10.04mg / g,在pH~2时,在50℃时最大吸附容量增加至98.04mg / g。拟二级模型证明了动力学数据的最佳描述。ΔG和ΔH的负值表明CB在ASAC上的吸附在研究的温度范围内是自发的和放热的。ΔS的正值清楚地表明在CB吸附到ASAC期间固溶界面的随机性增加,表明在吸附剂的活性位点和离子之间可能发生一些结构交换。活化能和速率常数随温度升高而增加,表明在高温下有利于吸附。ASAC对CB离子的吸附遵循伪二级动力学模型,其依赖于化学吸附可能是限速步骤的假设。在化学吸附中,CB离子通过形成化学键而附着到吸附剂表面,并且倾向于找到使其与表面的配位数最大化的位点。这项小批量研究产生了令人鼓舞的结果,