发布日期:2018-10-08 14:03 来源:活性炭网 作者:活性炭网 浏览数:
温度程序吸附平衡(TPAE)程序用于测定邻二甲苯和1-丙醇在300 K活性炭上的吸附热。表面覆盖度随吸附温度的变化( e = f(T a ))将Temkin模型与Temkin模型进行比较,以确定吸附的热量,
温度程序吸附平衡(TPAE)程序用于测定邻二甲苯和1-丙醇在300 K活性炭上的吸附热。表面覆盖度随吸附温度的变化(θe = f(T a))将Temkin模型与Temkin模型进行比较,以确定吸附的热量,并揭示每种吸附物的极性对活性炭表面的亲和力。已经表明,在低和高表面覆盖率下,邻二甲苯的吸附热分别在185Pa下为Eθ0 = 100kJ / mol和Eθ1 = 62kJ / mol。然而,发现在吸附平衡下1-丙醇的吸附热量取决于Eθ0的表面覆盖率在475Pa下, = 67kJ / mol,Eθ1 = 58kJ / mol。结果表明,对于吸附热的差异,邻二甲苯分子对活性炭表面的亲和力比1-丙醇更高。
| 关键词 | |
| 吸附平衡; 吸附热; Temkin模型; Langmuir模型; VOCs去除; 吸附建模 | |
| 介绍 | |
| 已知醇和苯衍生的化合物以及挥发性有机化合物(VOC)参与空气质量改变。这些化合物通常从石油化学加工工业,车辆和建筑/建筑材料中排放。他们的减少是预测其对人类健康的影响的优先事项[ 1 ]。的吸附-解吸/销毁构成目前用于预防在大气中[所述挥发性有机化合物排放大多数工艺2 - 5 ]。它们严重降低到最低水平需要具有大表面积和孔体积的吸附剂。沸石[ 2 ],金属-有机骨架(MOF)[4 ]和活性炭〔3,6 -8 ]是最常用的吸附剂,对VOC具有很强的吸附能力。 | |
| 活性炭已成为从空气[ 9 ]和水[ 10 ]中去除VOCs的几项研究的主题。活性炭上的气体吸附主要是Van Der Waals的分散和排斥力[ 11]。活性炭上的电荷很低,导致表面的电位梯度很低[ 12 ]。小孔径的存在对气体对活性炭的吸附能力起着重要作用[ 13]]。此外,表面基团对气体极性的吸附具有显着影响。因此,吸附量与表面氧化的网站,如羧基,内酯,羰基,醌,酚,醚,羧酸酐,内半缩醛...等的存在增加[ 11 - 13 ]。 | |
| 活性炭具有亲水和疏水吸附位点,可促进微孔中非极性和极性分子的吸附[ 14 ]。然而,一旦接近临界压力,在微孔和吸附压力中的中孔中就会发生冷凝[ 15 ]。Dobruskin [ 16 ]模拟了苯在微孔活性炭上的吸附(BET = 805 m2 / g,Vmicr = 0.42 cm3 / g),他得出结论,单层饱和后的拐点是在0.17的相对压力下获得的。 。对于醇类,Salame和Bandosz [ 17 ]研究了甲醇在几种微孔活性炭上的吸附; 他们注意到甲醇在0.3的相对压力下开始冷凝。Pre等人。[[11 ]进行了定量研究,以微量热法测定活性炭上VOCs的吸附热和活化能。他们研究了几个与木炭 - VOCs相互作用有关的参数,包括偶极矩,电离势,介电常数,极化率和表面张力。他们表现出这些变量之间的线性回归,吸附/解吸与电离势成反比,与极化率呈线性关系。吸附热发现在40-80kJ / mol的范围内。 | |
| 本研究的目的是使用程序升温吸附平衡法(TPAE)研究1-丙醇和邻二甲苯在活性炭上的吸附平衡所涉及的动力学参数(吸附和表面覆盖的热量)。因此,研究商业活性炭对不同吸附物(极性和/或非极性)的吸附性能具有重大的科学和实际意义。这些研究可以提供一些吸附剂参数的重要性的证据,包括吸附质的表面异质性和极性,并通过模拟吸附质/吸附剂系统中的相互作用来测量。此外, | |
| 试验 | |
| 物料 | |
| 选择来自Prolabo的活性炭(表示为AC)有两个主要目的:(a)它是微孔固体和(b)除了吸附外,它与OX或PrOH无反应性。在每次吸附前对AC样品进行预处理,以去除最终的吸附物痕迹,如下所示: | |
| 他,300 K→他,723 K(2小时)→他,300 K. | |
| 对于吸附实验,使用邻二甲基苯(Alfa Aesar,99%)和1-丙醇(VWR BDH Prolabo,99%)作为吸附物。干氦用作载气,纯度大于99.999%。 | |
| 吸附剂表征 | |
| 通过利用77K下氮物理吸附的等温线数据确定AC的结构性质(比表面积和孔体积)。氮气的吸附在自动Micrometrics ASAP 2010 V5.02H分析仪上进行,然后在样品中脱气。在相对压力<10 -7的真空中,873K,以确保干燥的表面和自由点的自由部位。 | |
| 图1显示了AC样品的氮吸附和解吸等温线。很明显,在AC上N2的吸附等温线具有典型的具有二次吸收的I型分布,这意味着存在微孔和中孔。BET和Langmuir表面积和孔体积在表1中给出。 | |
| 分析程序 | |
| 程序升温吸附平衡(TPAE),以前开发用于Pt / Al 2 O 3催化剂上的氢化学吸附[ 18],用于确定AC上PrOH和OX等重分子吸附平衡所涉及的动力学参数(吸附热和表面覆盖率),并评估其从大量流中去除VOC的效率。使用上述专用装置在动态条件下进行TPAE实验。简而言之,它由带有火焰离子化检测器(FID)的气相色谱(GC)组成,用于瞬态实验。该组件允许(i)在反应器入口中制备气体混合物并控制进料流速,(ii)在石英微反应器(1cm 3)中进行原位预处理,吸附和解吸步骤,以及(iii)监测OX通过GC-FID系统测定反应器出口中的PrOH和PrOH摩尔分数。 | |
| TPAE实验 | |
| 该实验TPAE的原理在别处报道[ 5,19 ]。简言之,如上所述处理约0.100g AC并在氦气下冷却至300K,以从表面除去水分和种类。然后,在大气压下,进行开关He x%PrOH / He或y%OX / He(使用公知的Antoine方程系数表,由饱和器/冷凝器系统固定的x和y)以开始吸附步骤和通过GC-FID以1/180Hz的频率分析反应器出口中的混合物。一旦反应器入口和出口的摩尔分数相等,则认为吸附平衡已确定。吸附温度(T a)在被吸附物(PrOH或OX)的异常分压下略微增加(0.5-1K / min),导致与正峰相关的ads的解吸附。在氦气下进行等温解吸,一旦摩尔分数在高温下再次相等,则验证了各种物种的完全解吸。最后,将AC冷却至室温。实验数据表示为突破曲线,显示摩尔分数随时间的演变。 | |
| 结果与讨论 | |
| 表面覆盖(θ)随温度(T a)和吸附压力(Pa)的变化允许测量吸附质/吸附剂系统中隐含的相互作用强度。各种物种的吸附热(用Eθ表示)及其表面覆盖度θ(0≤θ≤1)的演变构成了吸附物/吸附剂体系的基本特征。许多数学模型中的Temkin模型[20] 使用统计热力学描述了θ= f(T a)的曲线。该模型假设(i)种类是局部化的,(ii)吸附热随着表面覆盖度的增加而线性降低,(iii)异质表面位点和(iv)以及种间间接相互作用。Temkin模型由以下等式给出: | |
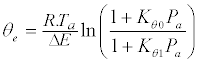 (1) (1) |
|
| 其中R是气体常数,Kθ0和Kθ1分别是低(θ= 0)和高覆盖(θ= 1)时的吸附系数: | |
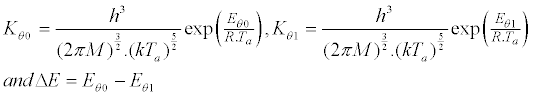 其中Eθ0和Eθ1分别是在低(θ= 0)和高(θ= 1)覆盖率下的吸附热。吸附热(E θ = E 一 -E d)是吸附的活化能(E之间的差一)和解吸(E d在吸附平衡)。 其中Eθ0和Eθ1分别是在低(θ= 0)和高(θ= 1)覆盖率下的吸附热。吸附热(E θ = E 一 -E d)是吸附的活化能(E之间的差一)和解吸(E d在吸附平衡)。 |
|
| 从方程式获得的理论曲线。1提供与所述吸附温度(T表面覆盖的演变一个通过假设E)θ0和E θ1,其与实验表面覆盖率变化比较允许吸附热(E的判定θ0和E θ1)。可以注意到,在TPAE步骤期间,通过增加吸附温度对平衡的轻微扰动导致约20%的吸附压力的轻微变化,其导致吸附热的变化为约3kJ / mol。该值被认为是由TPAE测定的吸附热的测量误差。 | |
| 在平衡时,表面覆盖率(θe(T a,P a))可以通过T a和P a处的吸附量(Q a)与形成单层(QML)的量的比率来确定: | |
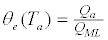 (2) (2) |
|
| 可以考虑固体的表面积(S = 1055m 2 / g)和吸附分子的横截面积σ(m 2 /分子)来计算Q ML(等式3): | |
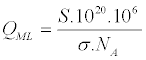 (3) (3) |
|
| 其中N A是阿伏加德罗数(N A = 6.02210 23分子,mol -1),S是表面积(m 2 / g),σ(m 2)是分子和吸附剂之间的横截面。后来由McCLellan和Harnsberger [ 21 ] 通过实验确定。他们发现,PrOH中和OX的横截面是约31和图48(a 2分别/分子)。考虑方程式在图3中,对于PrOH和OX,Q ML分别测定为约5650和3650μmol/ g。选择吸附压力显着小于吸附温度下饱和蒸汽所得的吸附压力(T a对于OX和PrOH,分别为= 300K),0.75%和2.3%。考虑TPAE峰处的摩尔分数计算这些值,其与在TPAE步骤期间增加20%的吸附物分压相关。在平衡时,TPAE步骤期间的表面覆盖度演变可以使用以下等式确定: | |
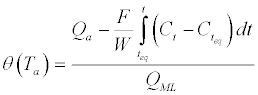 (4) (4) |
|
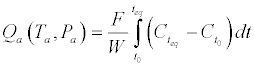 (5) (5) |
|
| 其中:Q a是T a和P a处吸附物的量(mol / g)。F是吸附物/ He 的流速(cm 3 / min)。W是吸附剂的重量(g)。C t0,Ct eq和C t分别是在吸附开始时(t 0),在建立平衡时(t eq)和在TPAE期间的任何时间在反应器出口处的吸附物的摩尔分数。实验(t> teq)。Q ML是形成吸附物的单层的量(mol / g)。 | |
| AC表征OX吸附平衡 | |
| 突破曲线允许监测吸附剂对吸附剂的负载随时间的变化。图2显示了在TPAE实验步骤期间存在的反应器出口处的0.183%OX / He混合物的摩尔分数(曲线(b))和不存在0.100g AC(曲线(a))的演变。OX在AC上的吸附步骤使用等压(P a = 185 P a)的OX在T a下进行在反应器中用AC进行100分钟后建立平衡,而空反应器的穿透时间小于分钟。使用等式1测定吸附的OX的量。5.从空反应器区域(曲线(a))减去(曲线(b))区域允许评估OX的吸附量。后来发现其为4160μmol/ g,对应于θe = 114%的AC表面覆盖率。这一结果可以解释为,在185 Pa和300 K时,由于在AC表面形成多层,孔隙部分地被OX分子填充[ 22]]。通过比较吸附体积与总孔体积可以验证该假设。实际上,这样的结果是一致的,因为AC的总孔体积为0.56cm 3 / g,接近相应的OX吸附体积(0.51cm 3 / g),即使吸附压力(185Pa)低于OX饱和压力为300 K(970 Pa),相对吸附压力为0.19。这一结果与Dobruskin的工作一致[ 16 ]。作者[16 ]模拟了苯在微孔活性炭上的吸附(BET = 805 m 2 / g,V micr= 0.42cm 3 / g),他得出结论,在0.17的相对压力下获得单层饱和后的拐点。 | |
| 一旦建立平衡(OX摩尔分数在反应器入口和出口处相等),在0.183%OX / He混合物下进行程序升温(1K / min),得到解吸的OX种的阳性和不对称峰。在TPAE期间解吸的OX物种的量使用方程式确定。在图5中,通过在300-550K的温度范围内从曲线(a)中减去曲线(b)的面积,发现为4130μmol/ g。在高温等温线中解吸的OX量为30μmol/ g。 | |
| 类似的结果通过施加高的吸附压力(680 P得到一个使用0.100克AC和下0.68%OX /赫混合物在300K的OX吸附量为大约4655微摩尔/克,其对应于所吸附的OX)直至平衡体积为0.56 cm 3 / g,与AC的总孔容相匹配,然后与AC的饱和度相匹配。然而,吸附电位不仅取决于吸附剂的特性,还取决于吸附剂的特性。具有窄微孔的材料比具有宽或无孔的材料吸附更多。AC对OX的吸附容量可与活性炭AC40(1300 m 2 / g)吸附二甲苯的吸附容量进行比较[ 23]并且远高于非多孔二氧化硅(220 m 2 / g)[5]。 | |
| 表征AC上的PrOH吸附平衡 | |
| 在AC上吸附PrOH进行了类似的OX吸附实验(图3)。使用0.147g AC和0.46%PrOH / He在300K下在70分钟内获得吸附平衡。使用相同的方法测定AC上OX的PrOH吸附量。在氦步骤下吸附,TPAE和解吸期间的PrOH吸收量分别为6050,5950和100μmol/ g。吸附量相当于0.45cm 3 / g,表示80体积%。填充孔的百分比和θe=在100K时相对压力为0.16时表面覆盖率的112%。研究吸附压力的影响以揭示AC的饱和极限。实验表明,吸附在AC上的PrOH的量随着吸附压力的增加而增加。事实上,在饱和压力和T a = 300K时,发现吸收量为7550μmol/ g,这相当于吸附的PrOH 的体积为0.56cm 3 / g。这些结果可以通过在表面上形成多层和在AC的孔中缩合PrOH分子来解释。然而。这些结果与Salame和Bandosz [ 17]的结果不同]。他们在类似的研究中注意到,甲醇在几个微孔活性炭上的吸附导致了颗粒间和毛细管毛细管凝结,从0.3施加相对压力开始。在相对压力下的冷凝中的差异可能与两个研究中使用的吸附剂的化学性质有关。另一方面,AC分别在420K和550K下完全再生为PrOH和OX; 不可能在以前的工作中发现对无孔二氧化硅吸附剂进行类似研究[ 5 ]。后来发现两种吸附物在400K左右容易再生。 | |
| 吸附平衡下AC上OX和PrOH的吸附热量 | |
| 图4中的实验曲线显示了通过使用(方程4)和(方程式5)从图2中的数据获得的θe = f(T a)的曲线图,并且提供了AC上的OX表面覆盖的演变。在TPAE实验期间T a > 300 K且P a = 185 P a(OX)。使用在TPAE步骤期间给定T a和Pa 下解吸分子的量与在AC表面上形成单层所需的OX 量的比率获得平衡表面覆盖度(方程4)。在300K和185 P 一,平衡表面覆盖度为θ Ë = 1.14和其变异θ ë = F(T 一(实验曲线,图4)使用Temkin模型(方程1)建模,考虑到吸附热取决于表面覆盖率,Eθ0 = 100 kJ / mol,Eθ1 = 62 kJ / mol,Pa = 185 P a。 | |
| 可以注意到,实验数据在300-360℃的温度范围内偏离理论模型。事实上,在这个温度范围内,表面覆盖率从1.14降至0.73,因为形成多层的OX基因的解吸和/或可能是由于冷凝的OX分子蒸发成AC孔[ 24 ]。然而,在T a > 360°C时,模型Temkin完美地拟合了实验数据曲线。该结果可以通过解吸形成单层AC表面的OX基质来解释; 与希尔一致[ 24]作者报道多层形成发生在表面覆盖度θ> 0.70的工作。另一方面,在吸附平衡下使用Temkin模型参数在高和低表面覆盖率下测定的AC上OX的吸附热发现与Pre等人发现的接近。[ 11 ]用于在活性炭上吸附甲苯(63至71kJ / mol),以及Dollimore等人发现的那些。[ 25 ]使用微量热技术和非多孔石墨(60 kJ / mol)上的间二甲苯的等量吸附热。作者[ 25]表明,在低表面覆盖率下,吸附热量远高于高表面覆盖率; 他们通过石墨表面不均匀的事实解释了他们的结果,低表面覆盖率下吸附热的高值与化学吸附在表面上的氧有关。Hockey和Pethica [ 26 ]研究了苯在二氧化硅上以各种形式吸附,他们已经证明微孔隙度和横向相互作用增加了二氧化硅低表面覆盖率下的吸附热。如果他们的理论是正确的,那么在低表面覆盖率(Eθ0 = 100 kJ / mol)下发现的高吸附热值是由于AC中存在微孔并且在高表面覆盖率下(Eθ1)= 62 kJ / mol)是由于低能量部位的氢物理吸附。吸附的第一个分子将位于高能量位点,分子将保持固定。达到高表面覆盖率的分子在吸附时释放的能量较少,并且由于冷凝可能形成稀释的移动膜。 | |
| 另一方面,在AC上吸附PrOH期间获得了类似的结果。图5描绘的PrOH中在AC表面覆盖的在475 P上的变化一个与所述吸附温度(T 一> 300 K)。Temkin模型在实验曲线上的拟合允许确定吸附热。后来发现这些是Eθ0 = 67kJ / mol,Eθ1在低和高表面覆盖率下分别为58kJ / mol。在高覆盖率下实验曲线的偏差可以注意到相同的评论。这可能与物理吸附在低能量位置的PrOH解吸有关。然而,可以注意到极性分子(PrOH)的吸附热被发现低于非极性分子(OX)的吸附热,并且OX的低和高表面覆盖率之间的吸附热差异很大。 (100 kJ / mol)与PrOH(67 kJ / mol)相比,我们假设OX的吸附热量在很大程度上与AC的微孔性无关,而与PrOH相比,特定位点的化学吸附现象无关。吸附物。吸附物和AC之间的相互作用的差异可以与它们的偶极矩的差异相关联。27,28 ]。该特征可能导致对AC表面位点的不同亲和力,并随后促进其吸附。 | |
| 通过使用Temkin模型和吸附平衡获得的活性炭上的PrOH的吸附热被发现与用于在AC上吸附醇化合物获得的等量加热一致。赫里等人。[ 29 ]已发现类似的乙醇吸附热(54.78 kJ / mol),1-丙醇(59.47 kJ / mol)和丁醇(76.87 kJ / mol),而Nastaj等。[ 30 ]和Salame Bandosz [ 17 ]发现,在AC上吸附2-丙醇为60.08 kJ / mol,乙醇为55 kJ / mol。然而,通过微量量热分析确定的吸附热是一种精确的工具,它被TPAE方法所接近。Pre等人。[ 11在AC的类似研究中,已发现乙醇(54.7kJ / mol)和异丙醇(55kJ / mol)的吸附,而Popescu等。[ 31 ]发现丁醇(63 kJ / mol)的结果相似。 | |
| 请注意,文献中给出的吸附热似乎是一个平均值,并没有考虑表面覆盖系数; 相比之下,TPAE方法给出了PrOH吸附热量随AC表面覆盖率的变化。 | |
| 在本研究中,获得的吸附热表明PrOH和AC表面之间的弱相互作用可能是由于非特异性相互作用(Van Der Waals力,伦敦力),并且与PrOH吸附是可逆的这一事实存在良好的一致性。 | |
| 结论 | |
| 本工作的主要目的是证明一种简单有效的方法来确定吸附热的兴趣。选择极性(丙醇)和非极性(邻二甲苯)分子用于在微孔吸附剂(活性炭)上吸附。OX和PrOH的吸附容量表明,两种吸附物分别在相对吸附压力分别为0.16和0.19的PrOH和OX下在300K的AC微孔中冷凝。通过使用程序升温吸附平衡(TPAE)方法确定了在物种平衡时吸附温度(Ta)的表面覆盖度(θe)的变化。通过对实验曲线建模确定吸附热(θe = f(T a))使用Temkin的理论模型,考虑到PrOH和OX的种类是局部的,并且发现吸附的热量取决于表面覆盖率。OX在AC的吸附热发现为E θ0 = 100千焦在低范围和E /摩尔θ1 = 62千焦耳/在高覆盖率摩尔。然而,发现AC上PrOH的吸附热量低于OX,Eθ0 = 67 kJ / mol,Eθ1在低和高表面覆盖率下分别为58kJ / mol。结论是,对于吸附热的差异,OX分子对AC表面的亲和力比PrOH更大。可以得出结论,TPAE实验可用于表征微孔吸附剂上极性或非极性分子吸附所涉及的相互作用。 | |