发布日期:2018-11-09 10:50 来源:活性炭网 作者:活性炭网 浏览数:
抽象 研究了三种药物,即对乙酰氨基酚,双氯芬酸和磺胺甲恶唑在颗粒活性炭(GAC)上的吸附。 为了研究竞争性吸附,通过仔细选择具有不同亲和力和分子大小的药物进行动态和稳态
最近,在水生环境中存在许多关注药物和个人护理产品(PPCP)的存在,例如河流,湖泊和废水处理厂。的PPCPs是一大组合成的化学物质包括各种治疗药物,非甾体类抗炎药(NSAIDs)的,止痛剂,抗生素,抗癫痫药,和血脂调节剂[的1 - 3 ]。尽管PPCPs仅在水生系统中以痕量水平检测到,但它们对人类和生态健康的潜在不利影响很大[ 4]。在这方面,需要研究PPCP在环境中的归宿,运输和生物累积。PPCP与水生颗粒物之间的相互作用是这些危险化学品运输的第一步。然而,由于PPCPs化合物的复杂性质,特别是在特定的官能团和物理化学性质中,PPCPs对天然存在的颗粒的吸附行为难以表征,其在水生系统中可能的多组分和多相相互作用进一步复杂化。
活性炭已提出是用于从水中去除的PPCPs的吸附剂由于诸如除了吸附技术[的可用性和成熟的孔隙率和大的比表面积其独特的物理化学性质5 - 8 ]。通常,在抛光步骤中应用活性炭以去除水处理中的难熔化合物和消毒副产物的前体[ 9 ]。
在各种各样的PPCP中,双氯芬酸,对乙酰氨基酚和磺胺甲恶唑是最常检测到的。双氯芬酸是一种镇痛药和NSAID,可以治疗炎症和疼痛,具有疏水性和低水溶性。对乙酰氨基酚通常用于治疗轻微的疼痛和疼痛,并且也是控制流感的药物的主要成分,其具有适度亲水性和高水溶性。磺胺甲恶唑是一种常见的抗生素,即杀菌剂,用于控制传染病,并且疏水性更强,水溶性低。另外,双氯芬酸的分子大小大于对乙酰氨基酚和磺胺甲恶唑的分子大小,这可能影响对活性炭的吸附行为。关于双氯芬酸的吸附特性已有很多报道[10 - 15 ],对乙酰氨基酚[ 13,16 - 21 ],和磺胺甲恶唑[ 14,22 - 25 ]上的各种吸附剂。大多数这些研究是使用纯水作为基质进行的,有或没有天然有机物存在,并且在单组分体系中,没有考虑来自其他PPCP的可能竞争。
应该注意的是,药物通常在水生环境中以多组分形式存在。预计这些药物之间将存在种间相互作用,与仅存在单一药物时相比,这将影响化学反应。然而,很少有研究考虑了竞争性吸附在多组分体系中的作用。因此,本研究的目的是评估具有不同分子大小和对活性炭亲和力的靶药物之间的竞争吸附。
由烟煤制成并由Calgon Carbon Corporation USA制造的Filtrasorb 400(F400)用于该研究。用去离子水洗涤粒状活性炭(GAC),然后在178K下干燥24小时。然后,将GAC粉碎并筛分成各种尺寸,即60,80,120,230和320目,平均直径分别为0.271,0.158,0.073,0.038和0.028mm。GAC的以下典型物理 - 化学性质如下所述:比表面积(BET法)= 1,156m 2 / g; 碘值= 1,077毫克/克; 颗粒密度= 0.85克/毫升; 灰分= 5%; 大孔体积(ψ > 50nm)= 1.5cm 3 / g; 微孔体积(ψ <2nm)= 0.38cm 3/G; 和等电点(pH pzc)= 8.9。
目标化合物,即双氯芬酸钠盐,对乙酰氨基酚和磺胺甲恶唑,购自Sigma-Aldrich的高效液相色谱(HPLC)级。表1显示了所研究的三种目标化合物的典型物理 - 化学性质。
目标化合物的物理化学性质。
| 对乙酰氨基酚 | 双氯芬酸 | 磺胺甲恶唑 | |
|---|---|---|---|
| 式 | C 8 H 9 NO 2 | C 14 H 11 Cl 2 NO 2 | C 10 H 11 N 3 O 3 S. |
|
|
|||
| 系统名称 | N-(4-羟基苯基)乙酰胺 | 2-(2-(2,6-二氯苯基氨基) - 苯基)乙酸 | 4-氨基-N-(5-甲基异恶唑-3-基) - 苯磺酰胺 |
|
|
|||
| 化学结构 |
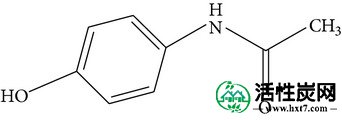 |
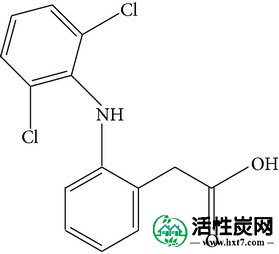 |
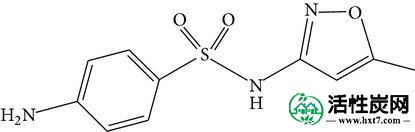 |
|
|
|||
| 分子量 | 151.17 | 296.15 | 253.28 |
|
|
|||
| 使用 | 镇痛和解热 | 非甾体类抗炎药和镇痛药 | 磺胺类抑菌抗生素 |
|
|
|||
|
在水中的溶解度 (mg / L,25°C)a |
3.035×10 4 | 4.47 | 3942 |
|
|
|||
| log ķ 流 一 | 0.46 | 4.51 | 0.89 |
|
|
|||
| p K aa(25°C) | 9.51 | 4 | 1.7; 6.56 |
a来自ChemSpider(http://www.chemspider.com/)。
单组分和多组分体系的平衡和动态吸附在间歇实验中以140rpm的搅拌速度进行72小时和25℃。当确定扩散系数时,目标化合物的初始浓度和GAC剂量分别保持恒定在10和10 mg / L,GAC的粒径从0.028 mm(320目)到0.271-0.758 mm不等。 (80-60目)。当确定吸附等温线时,初始目标化合物浓度在5至40mg / L之间变化,同时保持GAC剂量恒定在10mg并且粒度为60×80目72小时。按照上述步骤进行二元和三元组分体系的吸附,不同的是初始溶质浓度为10mg / L,GAC(60×80目)剂量为10mg / L. μ微米的过滤器),并分析所述目标药品的残留浓度之前在室温下储存。
目标化合物通过用C-18柱配备HPLC /紫外(UV)分析(RP示踪Extrasil ODS2 Micromet公司,250×4.6毫米,5 μ米粒径)在280nm的波长。使用由50%甲酸铵(10mM)和50%乙腈组成的流动相以1.25mL / min的流速分析双氯芬酸。对于对乙酰氨基酚和磺胺甲恶唑,流动相为30%甲醇和70%Milli-Q水,分别在254和273nm的紫外波长下检测。
根据以下表达式从吸附物的初始浓度和残留浓度确定吸附密度:
其中q t是时间t的吸附密度(mmol / g); V是溶液的体积(L); C 0是初始溶质浓度(mmol / L); C t是时间t的溶质浓度(mmol / L); 和米是GAC的使用量(克)。
在吸附动力学中,根据均匀颗粒扩散的概念,吸附物通过液膜从溶液相扩散到颗粒表面。有效扩散系数D e(cm 2 / s)可以通过将实验数据拟合到下面的等式[ 26 ] 来确定:
其中x (t)是在时间t(h)吸附的溶质分数,r是基于筛分分析和球形(cm)假设的颗粒的平均半径。
基于反应的吸附动力学由Lagergren伪第一和伪二阶速率方程描述[ 18 ]:
伪第一顺序:
伪二阶:
其中q e是平衡吸附密度(mmol / g),k 1(1 / h)和k 2(g mmol / h)是相应的吸附速率常数。
基于Langmuir等温线分析平衡吸附:
其中q max(毫摩尔/克)和b(L /毫摩尔)分别是最大(或单层覆盖密度)和Langmuir常数; C e是平衡溶质浓度(mmol / L)。
在非竞争二元吸附系统中,假设吸附位点相互或部分独立,并且溶质没有吸附干扰[ 19 ]。吸附等温线写成如下:
其中q e,A和q e,B(mmol / g)分别是化合物A和B的多组分吸附的平衡吸附密度; q max,甲(毫摩尔/克)和q max,乙(毫摩尔/克)是最大吸附密度甲和乙的单组分体系,分别为(从(5)); b A(L / mmol)和b B(L / mmol)是A和B的Langmuir常数在单组分溶液中,分别来自(5); C e,A (mmol / L)和C e,B(mmol / L)分别是A和B的多组分吸附的平衡浓度。
在二元系统中,当吸附位点相互或部分依赖并且溶质存在吸附干扰时,会发生竞争吸附[ 19 ]。以下改进的Langmuir吸附等温线可用于描述平衡时的竞争吸附密度[ 22 ]:
其中q e,i是第i化合物的多组分吸附的平衡吸附密度(mmol / g); q max,我和b 我(L / mmol)中是在用于单组分溶液得到朗缪尔参数我个吸附物; 和C e,i(mmol / L)是第i化合物的多组分吸附的平衡浓度。
在足够高浓度的吸附物中,1 < b A C e,A和1 < b B C e,A。等式(6)可以简化为以下内容:
平均相对误差(ARE)[ 22 ]用于评估二元系统中实验数据和计算数据之间的拟合精度,并表示为
其中q e,cal,i和q e,exp,i是第i组分的预测和实验平衡吸附容量(mmol / g),N是实验数据的数量。
图1显示了双氯芬酸,对乙酰氨基酚和磺胺甲恶唑在各种粒径下对GAC的动态吸附。结果表明,吸附密度受GAC粒径的影响; 也就是说,较细的颗粒表现出比较粗颗粒更高的吸附密度。粒径对吸附密度的影响可部分归因于比表面积的增加和碳外表面上的单层吸附[ 23 ]。
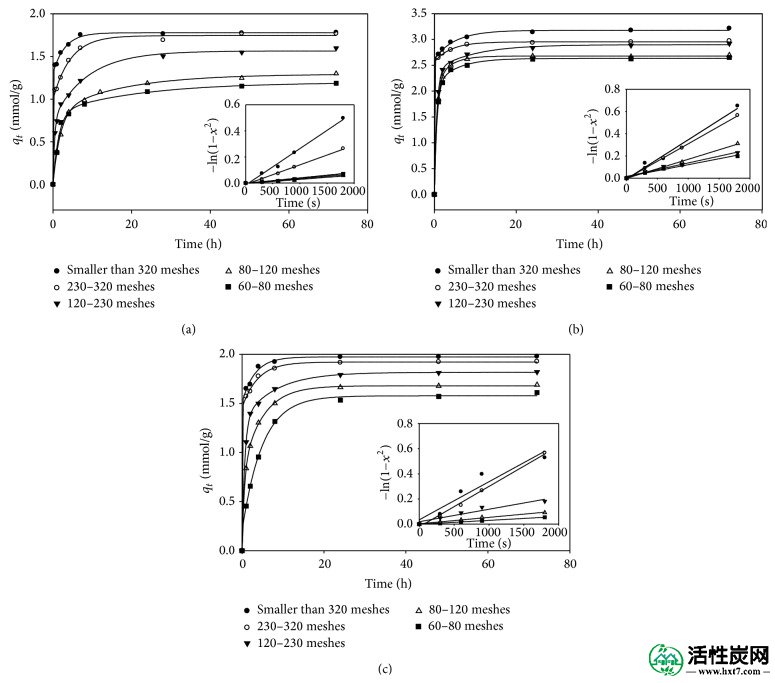
粒径对(a)双氯芬酸,(b)对乙酰氨基酚和(c)磺胺甲恶唑的吸附容量的影响(搅拌速度为140rpm,72小时和25℃。各目标化合物的初始浓度为10mg / L) 。
所述d ë根据(从吸附密度相对于时间的0〜0.5小时的范围内的图的斜率得到2)并且在所示表2。对于单一化合物,随着GAC粒径的减小,D e降低,但双氯芬酸的趋势不如其他两种化合物明显。等式(2)还表明,在一定条件下,有效扩散系数与粒子半径的平方成反比。通常,三种化合物的D e的相对标准偏差范围为0.20至0.28×10 -9 cm 2 / s,这表明D e仅在非常有限的程度上随GAC的粒度而变化。如果将液膜扩散控制假定为整个吸附过程的主要阻力,则较小的颗粒可以提供较小的阻力并因此增加有效扩散系数。然而,在该研究中,D e和GAC粒径呈现反比关系,这意味着液膜扩散可能不是主要的控制阻力。
对乙酰氨基酚,双氯芬酸和磺胺甲恶唑在GAC上的有效扩散系数。
| 粒径(网眼) | 有效扩散系数(10 -9 cm 2 / s) | ||
|---|---|---|---|
| 对乙酰氨基酚 | 双氯芬酸 | 磺胺甲恶唑 | |
| 60×80 | 7.47 | 4.75 | 9.33 |
| 80×120 | 6.43 | 3.82 | 8.65 |
| 120×230 | 6.11 | 2.73 | 7.46 |
| 230×320 | 5.20 | 2.63 | 5.74 |
| <320 | 3.44 | 2.65 | 3.29 |
|
|
|||
| 平均值±标准差 | 5.73±1.13 | 3.32±0.78 | 6.89±1.90 |
|
|
|||
| 相对标准偏差 | 0.20 | 0.23 | 0.28 |
注意到所选化合物的D e具有相同的顺序; 即,平均d ë对乙酰氨基酚,双氯芬酸,和磺胺甲恶唑的是5.73×10 -9,3.32×10 -9和6.89×10 -9 厘米2 /秒,分别不与目标化合物性质的任何明确的关系,例如,分子量。
进行动力学研究以获得经验或半经验方程式,用于吸附过程的进一步设计和操作。根据Lagergren伪一级(3)和伪二级动力学方程(4)计算速率常数。伪一阶方程(0.96-0.98)的回归系数略小于伪二阶方程(> 0.99),这表明吸附可以遵循动力学模式,但优选伪二阶 - 反应。图2显示了实验数据的由伪二级动力学方程的结果和所计算出的数据用的1.59×10的速率常数-5,5.74×10 -6 对乙酰氨基酚,双氯芬酸和磺胺甲恶唑分别为1.07×10 -5(g-mmol / h),与分子大小成反比。通常,有机微污染物在GAC上的吸附可以在固体和流体之间的许多不同步骤中描述,包括(1)质量传递过程,例如,溶质通过颗粒周围的液膜扩散(表面扩散)和溶质扩散通过GAC的吸附剂基质(颗粒内扩散),和(2)化学反应,通过该化学反应,吸附物与基质表面上的官能团形成化学键。
确定GAC的伪二级动力学模型; 假二级动力学模型:双氯芬酸,对乙酰氨基酚和磺胺甲恶唑(搅拌速度为140rpm,25℃,粒径为60×80目。各目标化合物的初始浓度为10mg / L)。
表3列出了由Langmuir等温线确定的平衡吸附系数。为Langmuir等温,最大平衡吸附密度( q max对乙酰氨基酚,双氯芬酸),以及磺胺甲基异恶唑为3.82,1.30,和1.80(毫摩尔/克),分别,与吸附物的分子量降低; 也就是说,最小的化合物对乙酰氨基酚表现出最高的吸附密度,而双氯芬酸具有最低的吸附密度。
单组分系统中Langmuir和Freundlich等温线的参数在GAC上。
(一个)
| Langmuir等温线 | |||
|---|---|---|---|
| q e(mmol / g) | q max(毫摩尔/克) | b(L / mmol) | |
| 对乙酰氨基酚 | 2.99 | 3.82 | 26.28 |
| 双氯芬酸 | 1.28 | 1.30 | 794.85 |
| 磺胺甲恶唑 | 1.76 | 1.80 | 167.17 |
(b)中
| Freundlich等温线 | ||
|---|---|---|
| ñ | K(mmol 1-1 / n L 1 / n / g) | |
| 对乙酰氨基酚 | 2.87 | 5.81 |
| 双氯芬酸 | 13.00 | 1.59 |
| 磺胺甲恶唑 | 4.62 | 2.97 |
Langmuir吸附常数b可用作吸附物和吸附剂之间亲和程度的指标; 即,更高的b值表示吸附剂[更大亲和力24,25 ]。从表3,很明显的是,b值与辛醇-水分配系数的(log排名一致ķ 流,在所示的表1)中的溶质的。从结果可以看出,对于较大的吸附物如双氯芬酸,吸附的限制因素不是传质速率,而是微孔的进入。
表4示出了吸附行为,在最大吸附密度(表示 q max)和朗缪尔常数( b),各种吸附剂。对乙酰氨基酚,该结果与其他作者的报道[协议 27, 28 ]。为双氯芬酸,GAC在两个亲和能力相比壳聚糖或有机的沸石[表现出良好的吸附特性 29 - 31 ]。相比之下,GAC对磺胺甲恶唑的吸附能力几乎与矿物沸石的吸附能力相同[ 32 ]。矿物沸石具有多孔结构,可以容纳多种阳离子,例如Na +,K+,Ca 2+和Mg 2+,通过形成特定的化学键可以提供额外的吸附,并产生更高的吸附能力。通常,活性炭(粉末或颗粒)能够为所研究的目标化合物提供足够的吸附能力。
将对乙酰氨基酚,双氯芬酸和磺胺甲恶唑的Langmuir等温线与各种吸附剂进行比较。
| 吸附剂 | 对乙酰氨基酚 | 双氯芬酸 | 磺胺甲恶唑 | |||
|---|---|---|---|---|---|---|
| q max(毫摩尔/克) | b(L / mmol) | q max(毫摩尔/克) | b(L / mmol) | q max(毫摩尔/克) | b(L / mmol) | |
| 颗粒状活性炭 |
3.82(本研究); 1.10至1.58 [ 33]; 1.32至1.77 [ 17] |
26.28(本研究); 63.3至97.8 [33 ]; 16.3至54.4 [17 ] |
1.30(本研究) | 794.85(本研究) | 1.80(本研究) | 167.17(本研究) |
|
|
||||||
| 粉状活性炭 | 呐 | 呐 | 呐 | 呐 |
0.73 [ 23 ]; 0.26至0.43 [ 24] |
185 [ 23 ]; 0.65到1.56 [24 ] |
|
|
||||||
| 壳聚糖 | 呐 | 呐 | 0.53 [ 34 ] | 25.7 [ 34 ] | 呐 | 呐 |
|
|
||||||
| 基于适体的专栏 | 呐 | 呐 | 0.09 [ 26 ] | 0.0001至0.0002 [ 26 ] | 呐 | 呐 |
|
|
||||||
| 有机沸石 | 呐 | 呐 | 0.13 [ 20 ] | 42.7 [ 20 ] | 0.71到1.90 [ 25] | 35至286 [ 25] |
na:不可用。
图3显示了二元系统中的动力学吸附。对乙酰氨基酚的吸附密度(图3(a)为双氯芬酸;图3(c)为磺胺甲恶唑)在吸附实验开始时由于其相对较高的扩散率而迅速增加,然后在稳态下略微降低至恒定值。结果显示,对乙酰氨基酚表现出比双氯芬酸或磺胺甲恶唑更低的亲和力。吸附的对乙酰氨基酚可能被双氯芬酸或磺胺甲恶唑代替,表明当反应增加时达到平台时吸附减少(图3(a)和3(c))。
(a)双氯芬酸和对乙酰氨基酚,(b)双氯芬酸和磺胺甲恶唑,和(c)对乙酰氨基酚和磺胺甲恶唑在二元混合物中的吸附能力(搅拌速度为140转/分钟,72小时和25℃。每个目标的初始浓度)化合物为10mg / L)。
此外,在双氯芬酸存在下对乙酰氨基酚的吸附密度(图3(a))几乎与磺胺甲恶唑存在时的吸附密度相同(图3(c))),即0.6mmol / g,这表明微孔的一部分仅被最小的目标化合物(对乙酰氨基酚)占据,但不被磺胺甲恶唑或双氯芬酸占据。因此,高竞争系统(即双氯芬酸存在下)中对乙酰氨基酚的稳态吸附密度可以基于微孔来估计,而其在低竞争系统中的吸附密度(即,在磺胺甲恶唑存在下)与孔径无关。另一方面,双氯芬酸 - 对乙酰氨基酚(图3(a))和双氯芬酸 - 磺胺甲恶唑之间的稳态吸附密度差异(图3(b))系统接近,这与他们的亲和力之间的差异相对应。由此得出结论,在稳态吸附之前,竞争和因此替换可能发生在两个吸附物之间的吸附密度差异显着的系统中。在稳态后,吸附密度主要由吸附物的亲和力和大小决定。
在多组分体系中,吸附行为可归类为非竞争性或竞争性。非竞争性吸附是由多组分体系中吸附位点的非特异性选择性引起的。如图图4(a),由(判断计算出的平衡吸附密度7)均从实验数据低估,具有超过19%至40%,这表明非竞争性吸附未描述吸附过程中的多组分体系。
根据(a)非竞争性吸附和(b)二元组分中的竞争吸附来比较实验数据和计算数据。
另一方面,多组分未修饰的Langmuir等温线(6)能够描述竞争性吸附行为(图4(b))。ARE的结果小于15%,这表明竞争吸附涉及多组分体系。然而,应该注意的是,在对乙酰氨基酚 - 磺胺甲恶唑体系中,对乙酰氨基酚的吸附密度被非竞争性低估,但是通过竞争吸附高度高估。值得注意的是,的log区别ķ 流这两种化合物的值,即0.46至0.86,远小于对乙酰氨基酚 - 双氯芬酸和磺胺甲恶唑 - 双氯芬酸体系的值。因此,可以理解,对乙酰氨基酚 - 磺胺甲恶唑系统可能处于非竞争吸附和竞争吸附之间。
表5中显示了单,二元和三元体系中三种目标化合物的稳态吸附密度。很明显,对乙酰氨基酚在多组分体系中表现出最大的吸附密度损失,从单一(2.99 mmol / g)到二元(0.59 mmol / g与双氯芬酸,0.60 mmol / g与磺胺甲恶唑,相应)或三级(0.32 mmol / g)系统。正如预期的那样,双氯芬酸的吸附密度从单一(1.28mmol / g)到二元(对乙酰氨基酚为0.96mmol / g,对磺胺甲基异丙醇为0.94mmol / g)或叔(0.83mmol / g)体系的吸附密度降低最少。因此,二元系统中的总吸附密度以两种模式变化。二元系统中的总吸附密度将大于单一双氯芬酸系统中的总吸附密度。例如,在双氯芬酸 - 磺胺甲恶唑体系中,由于利用了GAC的中孔,总吸附密度从1.28mmol / g增加到1.46mmol / g。
单,二元和三元体系下各目标化合物的吸附密度。
| 溶质系统 | 吸附(S) | 吸附密度(mmol / L) | |||
|---|---|---|---|---|---|
| 对乙酰氨基酚 | 双氯芬酸 | 磺胺甲恶唑 | 总 | ||
| 单 | 对乙酰氨基酚 | 2.99 | - | - | 2.99 |
| 双氯芬酸 | - | 1.28 | - | 1.28 | |
| 磺胺甲恶唑 | - | - | 1.76 | 1.76 | |
|
|
|||||
| 二进制 | 对乙酰氨基酚+双氯芬酸 | 0.59 | 0.96 | - | 1.55 |
| 双氯芬酸+磺胺甲恶唑 | - | 0.94 | 0.52 | 1.46 | |
| 磺胺甲恶唑+对乙酰氨基酚 | 0.60 | - | 1.20 | 1.80 | |
|
|
|||||
| 第三 | 对乙酰氨基酚+双氯芬酸+磺胺甲恶唑 | 0.32 | 0.83 | 0.47 | 1.62 |
图5显示了图3中两种药物之间吸附密度和log( K ow)的差异。有趣的是注意到,在吸附的降低(Δ q 吨)与log呈指数下降 ķ 流量值(Δlog ķ 流)。由于 K ow表示辛醇与水之间的化合物的平衡浓度,换句话说,表示化合物的低 K ow表现出亲水性和低吸附亲和性。从图5可知,log的差异( K ow )值增加,吸附密度差异减小,这意味着两个吸附密度之间的差异不太显着。换句话说,疏水性的差异越大,目标化合物的吸附密度与较小的K ow的差异越大。
两种药物之间吸附密度和log(K ow)值的差异。
在三级体系中,对乙酰氨基酚的吸附密度降低最高,即2.99-0.32mmol / g(降低约89%),双氯芬酸最小,即1.28-0.83mmol / g。 (减少约35%)。结果表明,目标化合物对GAC的亲和力清楚地反映出来。另一方面,即使混合物中每种药物的吸附密度远低于单溶质体系中的吸附密度,与双氯芬酸相比,三级体系中的总吸附密度高达1.62 mmol / g。只有双氯芬酸 - 对乙酰氨基酚和双氯芬酸 - 磺胺甲恶唑二元体系。结果可以通过限制孔径或通过这些药物形成多层的后续吸附来解释[23 ]。由此得出结论,在由多种亲和力和大小的吸附物组成的多组分体系中,竞争吸附可能显着影响大孔中的吸附,而对中孔或微孔的吸附则较少。
随着GAC颗粒变得更细但与MW无关,吸附物在GAC中的有效扩散系数增加。对于单组分体系,吸附反应的动力学可以通过拟二级动力学表达来描述。Langmuir吸附等温线参数的结果表明,b与辛醇 - 水分配系数(K ow)的排序一致。与其他吸附剂如壳聚糖或沸石相比,活性炭对所研究的药物表现出最有利的亲和力。
基于ARE计算,二元和三元体系中的吸附行为本质上是竞争吸附。在稳态前的二元系统中,当两个吸附物的亲和力表现出显着差异时,就发生了吸附置换,即K ow,例如对乙酰氨基酚 - 双氯芬酸系统。稳态吸附密度主要由吸附物的亲和力和大小决定。具有最低亲和力的吸附物产生最小的吸附密度,这表明微孔的一部分仅被小目标化合物占据,但不能吸附更大的吸附物。因此,在多组分体系中,当存在具有各种亲和力和尺寸的吸附物时,竞争可能显着影响大孔中的吸附而在中孔或微孔中的吸附较少,这可以提供选择和优化操作条件的标准。