发布日期:2018-11-19 10:05 来源:活性炭网 作者:活性炭网 浏览数:
背景 安全,廉价和有效的辅助治疗可以预防严重疟疾的发展或降低其死亡率,这可能会对公共卫生产生巨大而迅速的影响。 口服活性炭(oAC)是一种安全且耐受性良好的急性中毒治疗
严重的疟疾包括主要由恶性疟原虫感染引起的广泛的临床综合征,估计每年导致0.5-1百万非洲儿童死亡[1]。除了脑疟疾(CM)的神经系统综合征外,儿童严重疟疾的死亡可能是由于严重的贫血和/或呼吸窘迫导致代谢性酸中毒。虽然严重疟疾的病理生理基础复杂,可能包括[2],[3]的变形能力降低以及[4] - [6]的细胞粘附性。寄生的红细胞,尽管如此,仍然有人提出令人信服的论据,说明促炎细胞因子在疾病的许多方面的重要作用[7] - [9]。未能打破由过量细胞因子产生引起的代谢变化的恶性循环,显着地导致观察到的高死亡率。然而,通过靶向单个细胞因子(特别是TNF)来提高存活率的尝试在很大程度上是不成功的[10]。因此,我们研究了克服这种细胞因子级联的不利影响的替代方法,以期确定适合在资源贫乏国家使用的干预措施,并且鉴于临床急需,可迅速用于临床。
三项观察结果使我们研究了活性炭(AC)在治疗严重疟疾中的潜在作用。首先,许多研究表明,在离体血液滤过中,AC在从血流中吸附一系列内毒素诱导的细胞因子方面非常有效,包括TNF,IL-1和IL-6 [11]。其次,内毒素血症模型中TNF依赖性致死率与通过胆管将TNF递送至肠腔相关。因此,胆管插管可以保护大鼠免受致命的内毒素血症[12](Ulloa et.al.未发表),提高了肠腔中AC可能直接影响细胞因子可用性的可能性。第三,oAC多年来一直用于临床以通过间接调节炎症来抑制慢性肾病[13]。
我们现在在这项研究中报告,口服AC(oAC)接近实验CM(ECM)的发病时间,即使面对高寄生虫血症,也能保护小鼠免于死亡并延长总体存活时间。对脾T细胞细胞因子产生的分析发现,oAC处理与致力于产生TNF和IFNγ的CD4 +和CD8 + T细胞数量减少相关,并且基因表达谱鉴定了与oAC介导的ECM保护相关的全血“特征”。基于这些有希望的结果,我们进行了一项临床试验,以评估oAC是否会改变肠外青蒿琥酯(AS)的药代动力学,这是目前最有效的严重疟疾化疗[14]。,发现oAC对曲线下面积(AUC)或AS或其活性代谢物双氢青蒿素(DHA)的血清半衰期几乎没有影响。总之,这些数据鼓励未来的研究评估oAC在人类疟疾中的潜在功效。
C57BL / 6小鼠购自Harlan,并在伦敦卫生和热带医学学院的屏障条件下饲养。在所有实验中使用的小鼠是性别匹配的并且在6周龄时使用。P. berghei ANKA(PbA)最初来自N.Wedderburn博士(英国伦敦皇家外科医学院),并且在C57BL / 6小鼠中一次体内传代后用于所有实验。用10 4静脉内感染小鼠寄生的红细胞(pRBC)。Actidose-Aqua®活性炭(0.2g炭/ ml)从Paddock laboratories,Inc。(Cat#NDC0574-0121-04)获得,并且在感染后第3天和第5天(pi)小鼠随机接受130mg基于内毒素血症模型(Ulloa等,未发表)或单独盐水的初始剂量滴定研究,炭/ kg(在100μl体积盐水中口服给药)。在一些研究中,在洗涤到无菌生理盐水中之后使用Actidose-Aqua?木炭,或者使用替代的活化颗粒炭源(Aktivkohle,Granulat,1.5mm,由Caesar&Loretz GmbH,Germany重新安装)。在给药期间小鼠未被麻醉或镇静,因为这经常导致气道污染。监测小鼠的CM神经系统体征,包括惊厥,每天频繁发生共济失调和瘫痪。寄生虫负荷由吉姆萨染色的血涂片确定,并表示为pRBC的百分比。使用血细胞计数器通过在1ml RPMI中稀释2μl尾血来计数RBC。根据英国内政部指南(1986年动物(科学程序)法案),每天晚上监测动物并在第二天早晨被认为不可避免时死于宫颈脱位而死亡。通过心脏穿刺收获血液以分离PBMC。小心取出脑组织并用4%甲醛生理盐水固定以进行蜡包埋,并制备组织切片用于苏木精和伊红染色。使用血细胞计数器通过在1ml RPMI中稀释2μl尾血来计数RBC。根据英国内政部指南(1986年动物(科学程序)法案),每天晚上监测动物并在第二天早晨被认为不可避免时死于宫颈脱位而死亡。通过心脏穿刺收获血液以分离PBMC。小心取出脑组织并用4%甲醛生理盐水固定以进行蜡包埋,并制备组织切片用于苏木精和伊红染色。使用血细胞计数器通过在1ml RPMI中稀释2μl尾血来计数RBC。根据英国内政部指南(1986年动物(科学程序)法案),每天晚上监测动物并在第二天早晨被认为不可避免时死于宫颈脱位而死亡。通过心脏穿刺收获血液以分离PBMC。小心取出脑组织并用4%甲醛生理盐水固定以进行蜡包埋,并制备组织切片用于苏木精和伊红染色。
从未感染的小鼠,PbA感染的小鼠和PbA感染的,AC处理的小鼠和通过使组织通过100μm细胞过滤器产生的单细胞悬浮液中分离脾脏。使用Gey溶液裂解红细胞,并在完全RPMI-1640(补充有2mM L-谷氨酰胺,100U / ml青霉素和100μg/ ml链霉素,加上5%胎牛血清的RPMI)中洗涤细胞两次。细胞i)直接在10μg/ ml布雷菲德菌素A(Sigma-Aldrich,UK)中离体培养4小时或ii)通过与10ng / ml PMA(Sigma-Aldrich,UK)和1孵育再刺激2小时。在加入布雷菲德菌素A之前,μg/ ml离子霉素(Sigma-Aldrich,UK)。孵育后,将细胞用PBS,5mM EDTA,2%FCS洗涤,并用藻红蛋白(PE)-Cy7缀合的抗CD3ε(145-2C11)标记。 ,eBioscience,英国),PerCP缀合的抗CD4(RM4-5)和别藻蓝蛋白(APC)缀合的抗CD8α(53-6.7,均来自BD Pharmingen,San Diego,USA)在冰上30分钟。标记后,将细胞在PBS,5mM EDTA,2%FCS中洗涤两次,并在多聚甲醛中固定。通过在含有0.5%牛血清白蛋白和0.5%皂苷的PBS中洗涤,然后用Pacific Blue缀合的抗-IFN-γ(XMG1.2)和PE缀合的抗-TNF-α(MP5-XT22)的组合进行标记,使细胞透化,或适当的同种型对照(均来自eBioscience,UK)在冰上45分钟。标记后,将细胞在含有皂苷的缓冲液中洗涤,并在不含皂苷的缓冲液中洗涤两次。使用Summit分析软件(Beckman Coulter)在CyAn ADP流式细胞仪中对> 100,000个细胞进行流式细胞术分析。来自BD Pharmingen,San Diego,USA)在冰上30分钟。标记后,将细胞在PBS,5mM EDTA,2%FCS中洗涤两次,并在多聚甲醛中固定。通过在含有0.5%牛血清白蛋白和0.5%皂苷的PBS中洗涤,然后用Pacific Blue缀合的抗-IFN-γ(XMG1.2)和PE缀合的抗-TNF-α(MP5-XT22)的组合进行标记,使细胞透化,或适当的同种型对照(均来自eBioscience,UK)在冰上45分钟。标记后,将细胞在含有皂苷的缓冲液中洗涤,并在不含皂苷的缓冲液中洗涤两次。使用Summit分析软件(Beckman Coulter)在CyAn ADP流式细胞仪中对> 100,000个细胞进行流式细胞术分析。来自BD Pharmingen,San Diego,USA)在冰上30分钟。标记后,将细胞在PBS,5mM EDTA,2%FCS中洗涤两次,并在多聚甲醛中固定。通过在含有0.5%牛血清白蛋白和0.5%皂苷的PBS中洗涤,然后用Pacific Blue缀合的抗-IFN-γ(XMG1.2)和PE缀合的抗-TNF-α(MP5-XT22)的组合进行标记,使细胞透化,或适当的同种型对照(均来自eBioscience,UK)在冰上45分钟。标记后,将细胞在含有皂苷的缓冲液中洗涤,并在不含皂苷的缓冲液中洗涤两次。使用Summit分析软件(Beckman Coulter)在CyAn ADP流式细胞仪中对> 100,000个细胞进行流式细胞术分析。通过在含有0.5%牛血清白蛋白和0.5%皂苷的PBS中洗涤,然后用Pacific Blue缀合的抗-IFN-γ(XMG1.2)和PE缀合的抗-TNF-α(MP5-XT22)的组合进行标记,使细胞透化,或适当的同种型对照(均来自eBioscience,UK)在冰上45分钟。标记后,将细胞在含有皂苷的缓冲液中洗涤,并在不含皂苷的缓冲液中洗涤两次。使用Summit分析软件(Beckman Coulter)在CyAn ADP流式细胞仪中对> 100,000个细胞进行流式细胞术分析。通过在含有0.5%牛血清白蛋白和0.5%皂苷的PBS中洗涤,然后用Pacific Blue缀合的抗-IFN-γ(XMG1.2)和PE缀合的抗-TNF-α(MP5-XT22)的组合进行标记,使细胞透化,或适当的同种型对照(均来自eBioscience,UK)在冰上45分钟。标记后,将细胞在含有皂苷的缓冲液中洗涤,并在不含皂苷的缓冲液中洗涤两次。使用Summit分析软件(Beckman Coulter)在CyAn ADP流式细胞仪中对> 100,000个细胞进行流式细胞术分析。将细胞在含有皂苷的缓冲液中洗涤,并在不含皂苷的缓冲液中洗涤两次。使用Summit分析软件(Beckman Coulter)在CyAn ADP流式细胞仪中对> 100,000个细胞进行流式细胞术分析。将细胞在含有皂苷的缓冲液中洗涤,并在不含皂苷的缓冲液中洗涤两次。使用Summit分析软件(Beckman Coulter)在CyAn ADP流式细胞仪中对> 100,000个细胞进行流式细胞术分析。
一组20只雌性C57BL / 6小鼠用PbA感染,并且在第3和第5天,10只小鼠接受oAC,如上所述。在第6天,在未经治疗的PbA感染小鼠首次死亡之前,5只未经处理的PbA感染小鼠(第1组)和5只oAC处理的PbA感染小鼠(第2组)被杀死并且新鲜血液(300-500)收集每只小鼠μl,并使用Mouse RiboPure TM -Blood RNA分离试剂盒(Ambion)根据制造商的说明加工成RNA。还从未感染的对照小鼠('基线')中采集血液。然后跟踪每组中剩余的感染小鼠以发展ECM。根据制造商的方案分离总RNA。使用210 Bioanalyser(Agilent Technologies,Palo Alto,CA)建立RNA浓度和完整性。来自每只小鼠的RNA样品独立处理。使用Affymetrix GeneChip单循环靶标记试剂盒(Affymetrix,Santa Clara,CA),根据制造商推荐的方案将提取的RNA逆转录成cDNA,并与GeneChip®Mouse430 2.0 Genome Array杂交。使用Affymetrix GCOS 1.2软件进行原始数据处理。在杂交和扫描后,通过MAS5算法计算探针细胞强度并总结各探针组。收集MAS5标准化数据并使用ArrayAssist Expression软件5.5版(Stratagene)进行分析。将来自个体全血基因表达谱的原始数据过滤表达水平,丢弃最低20 CA)根据制造商推荐的方案并与GeneChip®Mouse430 2.0 Genome Array杂交。使用Affymetrix GCOS 1.2软件进行原始数据处理。在杂交和扫描后,通过MAS5算法计算探针细胞强度并总结各探针组。收集MAS5标准化数据并使用ArrayAssist Expression软件5.5版(Stratagene)进行分析。将来自个体全血基因表达谱的原始数据过滤表达水平,丢弃最低20 CA)根据制造商推荐的方案并与GeneChip®Mouse430 2.0 Genome Array杂交。使用Affymetrix GCOS 1.2软件进行原始数据处理。在杂交和扫描后,通过MAS5算法计算探针细胞强度并总结各探针组。收集MAS5标准化数据并使用ArrayAssist Expression软件5.5版(Stratagene)进行分析。将来自个体全血基因表达谱的原始数据过滤表达水平,丢弃最低20 通过MAS5算法计算并总结各探针组的探针细胞强度。收集MAS5标准化数据并使用ArrayAssist Expression软件5.5版(Stratagene)进行分析。将来自个体全血基因表达谱的原始数据过滤表达水平,丢弃最低20 通过MAS5算法计算并总结各探针组的探针细胞强度。收集MAS5标准化数据并使用ArrayAssist Expression软件5.5版(Stratagene)进行分析。将来自个体全血基因表达谱的原始数据过滤表达水平,丢弃最低20日代表非表达基因的百分位数,产生39,299个基因列表。该列表首先针对具有通过错误发现率(Benjamini和Hochberg假发现率)校正的P值小于0.05的基因进行过滤,然后通过指定三组中任何一组之间的表达差异至少2倍来进行过滤。以这种方式产生的12,365个基因列表进一步过滤仅在oAC处理的和未处理的PbA感染的小鼠之间差异表达的基因,产生99个基因的列表。将其进一步手动过滤以去除具有不可预测水平的交叉杂交的重复和探针,并产生68基因列表。在GeneSpring v7.3.1中执行分层聚类(使用欧几里德距离度量和质心链接矩阵),允许构建显示样本树和基因树的热图。来自这些研究的数据已存放在EBI ArrayExpress数据库(登录号:E-MEXP-2594)中。
为了评估oAC的影响,结果表示来自4个独立实验的汇集数据,涉及总共23个对照和31个oAC处理的小鼠。生存曲线的产生,对数秩检验和风险比的计算均在Prism v5.01(GraphPad软件公司)中进行。对于细胞因子分析,从分析的两个独立实验(每个处理组n = 10只小鼠和10只未感染对照小鼠)合并数据。使用Kruskal-Wallis非参数ANOVA(所有比较p <0.0001)分析数据,Dunn's post test用于比较每种细胞因子的结果。为了比较有和没有治疗的小鼠中的全局基因表达谱,使用三组10只小鼠(未感染的'基线',感染和治疗,感染和未治疗)。在d5处死每个处理组5只小鼠用于基因表达分析,并允许5只小鼠继续发展ECM。Fisher's Exact Test用于分析第9天对ECM的保护作用。如上所述分析来自微阵列分析的数据。
该药代动力学研究是根据ICH / GCP指南于2007年2月至6月在冈比亚Farafenni的武装部队临时执政委员会(AFPRC)综合医院进行的开放标签随机对照试验,并由MRC Gambia Unit Clinical独立监测试验支持经理。主要目的是评估口服AC是否同时或在1小时后改变静脉内应用的AS及其代谢产物双氢青蒿素(DHA)的药代动力学。该试验的协议和支持CONSORT清单可作为支持信息; 参见清单S1和协议S1。
在对18个村庄进行初步宣传后,所有成年人(21-45岁)的居民都被邀请参加会议,在此期间,对研究的细节进行了解释,并向感兴趣的研究人员提供了信息表。共有187自愿获得了其口头同意了筛选,并测出疟疾寄生虫(OptiMAL- IT ®测试,DiaMed AG,Cressier,瑞士)和贫血症(Hemocue光度计,Hemocue,Angelholm,瑞典)。在医院出现后,通过幻灯片显示再次确认寄生虫阴性状态,并使用尿液浸渍棒排除妊娠。在获得书面知情同意书后,招募了52名健康成人(疟疾阴性,Hb> 11 g / dl,前一周未报告药物摄入,未怀孕),并在研究病房住院24小时。为了确保每15名参与者后每组人数相等,志愿者被随机分配到三个研究组之一,使用Excel,Microsoft的随机数生成函数生成的随机数。按随机数生成器出现的顺序,这些数字分别由PI分配给组1,2或3,因此,在每组15个数字之后,保证所有三个组的平均分配。然后将标有组号1至3的卡放入标有随机分配给每组的数字的信封中。然后将密封的信封按升序排列,并由研究医师按照他们参加研究的顺序一个接一个地分配给符合条件的受试者。该研究包括以下手臂:手臂1(对照),接受静脉注射AS和水; 手臂2,同时接受静脉注射AS和口服AC; 和手臂3,1小时后接受静脉注射AS和口服AC。每个治疗方案对每个人进行两次,从入院开始到此后12小时。然后将标有组号1至3的卡放入标有随机分配给每组的数字的信封中。然后将密封的信封按升序排列,并由研究医师按照他们参加研究的顺序一个接一个地分配给符合条件的受试者。该研究包括以下手臂:手臂1(对照),接受静脉注射AS和水; 手臂2,同时接受静脉注射AS和口服AC; 和手臂3,1小时后接受静脉注射AS和口服AC。每个治疗方案对每个人进行两次,从入院开始到此后12小时。然后将标有组号1至3的卡放入标有随机分配给每组的数字的信封中。然后将密封的信封按升序排列,并由研究医师按照他们参加研究的顺序一个接一个地分配给符合条件的受试者。该研究包括以下手臂:手臂1(对照),接受静脉注射AS和水; 手臂2,同时接受静脉注射AS和口服AC; 和手臂3,1小时后接受静脉注射AS和口服AC。每个治疗方案对每个人进行两次,从入院开始到此后12小时。并且由研究医生按照他们参加研究的顺序一个接一个地分配给符合条件的受试者。该研究包括以下手臂:手臂1(对照),接受静脉注射AS和水; 手臂2,同时接受静脉注射AS和口服AC; 和手臂3,1小时后接受静脉注射AS和口服AC。每个治疗方案对每个人进行两次,从入院开始到此后12小时。并且由研究医生按照他们参加研究的顺序一个接一个地分配给符合条件的受试者。该研究包括以下手臂:手臂1(对照),接受静脉注射AS和水; 手臂2,同时接受静脉注射AS和口服AC; 和手臂3,1小时后接受静脉注射AS和口服AC。每个治疗方案对每个人进行两次,从入院开始到此后12小时。
对所有参与者进行临床评估,全血细胞计数(FBC)和常规生物化学。在0小时和12小时后,以2.4mg / kg体重的剂量静脉内给予所有研究参与者的碳酸氢盐(桂林制药)中的AS。口服给予50克AC(Aktivkohle,Granulat,1.5毫米; Caesar&Loretz GmbH,德国)在350毫升水中的溶液。在施用第二剂药物之前重复临床评估。在第二剂AS(第12小时)后5,10,15,30,60和90分钟以及3小时和6小时取血样并立即离心(420g,在环境温度下10分钟)。将血浆在液氮中快速冷冻,没有延迟。在出院前,重复常规生化和临床评估。
试验终点是在给予第二剂青蒿琥酯后,通过高效液相色谱(HPLC) - 质谱(MS,Thermo Acella HPLC和Thermo Quantum Access质谱仪)测量AS及其代谢物DHA的血浆水平(at 12小时),并确定他们的C max,t max,t½和AUC。MS以正加热电喷雾电离模式操作,喷雾电压为4.5KV,毛细管温度为250℃。将包含60%乙腈和40%0.1M乙酸铵的流动相以450uL /分钟的流速运行4分钟。使用与相同包装材料的保护柱连接的Thermo Betasyl Phenyl Hexyl 2.1×50mm HPLC柱分离AS和DHA。青蒿素用作内标。分析验证1-2000 ng / mL。所有样本都用三位数的标识符编码,实验室的研究人员对每个志愿者的组分配不知情。
数据被双重输入Access数据库。主要终点是AS和DHA的每个受试者的浓度 - 时间曲线(AUC)下的面积。使用S-Plus®的nlminb功能,通过最小二乘法为每个人拟合单室药代动力学模型。对于一些受试者,AS水平的一室模型产生非常高度相关的参数估计,可能是因为采样方案没有跟踪AS血浆水平的非常快速的初始上升。出于这个原因,还为每个受试者的AS数据拟合了一个简单的指数模型,并通过方差分析(ANOVA)与单个隔室模型进行比较。如果p值小于0.1,则从单室模型获取AS的参数估计,否则从简单指数获得。AUC估计为剂量除以CL / F,其中CL是清除率,F是生物利用度。由于F未知,因此CL / F被估计为单个参数。通过ANOVA比较试验组之间的AUC和其他药代动力学参数估计值。通过对比获得参数估计的几何平均值之间的臂间差异的置信区间[15]。
为了达到80%的功效来检测平均AUC或其他药代动力学参数的平均值之比,在对照组和任一干预组之间,变异系数为50%,双侧显着性水平为5%,我们计算出23每组受试者是必要的[16]。我们能够招募52个人(计算样本量的75%)。由于后勤限制,52名研究参与者中46%的样本只能在储存20个月后进行统计分析。不幸的是,DHA获得了相当难以置信的特征,即在15-30分钟内观察到快速下降,无论研究组如何,可能是由于即使在-80℃下样品在储存时衰变。因此,这些数据被排除在进一步分析之外
所有动物实验均根据英国内政部规定,根据LSHTM动物伦理程序委员会批准的方案进行。该临床研究由冈比亚MRC科学协调委员会,LSHTM和约克大学伦理委员会以及冈比亚联合政府/ MRC伦理委员会审查和批准,并在ISRCTN(Nr.64793756)注册。
为了检验口服AC可能对严重疟疾的结果有益的假设,我们使用了由C57BL / 6小鼠中的伯氏疟原虫ANKA(PbA)感染引起的ECM模型。这是人类疾病许多方面广为接受的模型; 促炎细胞因子丰富; 小鼠出现中枢神经系统乳酸性酸中毒,血脑屏障通透性增加,瘫痪,癫痫发作和死亡; 脑组织病理学有相似之处[17]。感染PbA的所有未治疗小鼠在感染后(pi)5-6天出现严重的神经症状,包括惊厥和共济失调,此后几乎不可避免地死亡(在6-9天的时间窗内。如图1a所示)在感染了PbA的未治疗小鼠中,仅有5/23(21.7%)小鼠在第7天存活,0/23(0%)在第9天存活。相反,在第3天和第5天通过口服强饲法给予AC(Actidose-Aqua®)的小鼠对ECM的发展具有高度抗性,其中27/31(87.1%)在第7天和第17/31(54.8%)存活。在第9天幸存(图1a)。由于没有给予抗疟疾药物,oAC治疗的小鼠最终变得超寄生虫并且死亡,可能是贫血症。尽管如此,OAC显著延长总体存活时间(图1。一个 ;χ 2 1 = 37.8,P < 0.0001; 风险比16.4; 95%CI的比例:6.73-40.1)。引人注目的是,一些处理过的动物长期存活,尽管寄生虫病超过75%(图1b)。为了证实这些结果可归因于Actidose-Aqua®的木炭成分而不是商业稀释剂中的其他可能因素,我们将AC分离并将其施用于重悬于生理盐水中的小鼠,其他小鼠接受原始稀释剂。 。在该实验中,用稀释剂处理的5/5的小鼠单独从ECM死于D7 PI,而0/5的小鼠Actidose-Aqua®处理-衍生的AC死于第9天pi和3/5存活超过10天(χ 2 1 = 9; p = 0.003)。接下来,我们分别采购颗粒形式的AC原液,并在粉碎成粉末后,将其作为盐水悬浮液给药。该混合物在防止ECM方面也非常有效(40%保护对盐水对照,p = 0.002)并且对寄生虫血症或贫血没有影响(数据未显示)。为了评估oAC治疗的时机是否对其有效性至关重要,我们在不同的时间表中给予了oAC。在第4天,第5天和第6天给予oAC与在第3天和第5天给予oAC一样有效地保护ECM。(对于d3 + 5对d4 + 5 + 6,用oAC处理的小鼠的存活率p = 0.54)。在第6天开始单次剂量的oAC仍然足以保护小鼠免于快速死于ECM(分别对于oAC治疗和未治疗的PbA感染小鼠,第7天存活率分别为100%和40%),尽管最终所有在第9天仅接受单剂量oAC的小鼠死于ECM。我们得出结论,oAC虽然对寄生虫血症没有重大影响,但在症状出现前或出现时对ECM的发展具有高度保护作用。由于在这种时候口服AC给小鼠的实际困难,不能测试在症状发作后对小鼠重复给予oAC的效果。
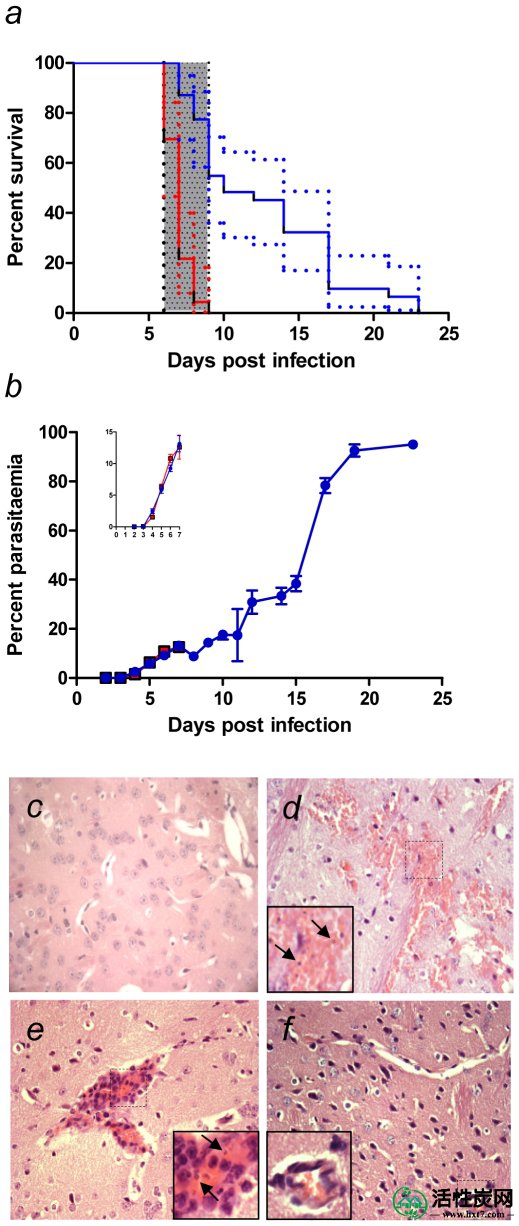
a)用PbA感染C57BL / 6小鼠并且未处理(红线)或在d3和d5用oAC(蓝线)处理。在25天的时间内监测存活率。CM死亡的窗口(d6-9)由阴影条表示。从5个独立实验(n = 23个未处理的和n = 31个oAC处理的小鼠)合并数据,并显示95%CI(虚线)。通过oAC治疗显着改善总体存活率(p <0.0001)。b)显示用PbA(空心方块)感染的小鼠和用oAC(实心方块)处理的PbA感染小鼠中的寄生虫病。数据代表平均值±SEM。插入物显示寄生虫在d1-7上方,为清楚起见放大。C-F)正常小鼠的脑组织病理学(c),用PbA(d,e)感染6天的小鼠和用PbA感染并用oAC处理的小鼠(f)。在d)和e)中,插入物显示血管周围出血和寄生RBC区域(箭头)。H&E染色; 原始放大倍数×40。
为了确定oAC治疗是否阻止了与CM相关的脑组织病理学,脑切片用苏木精和曙红染色。与正常脑相比(图1c),来自未经治疗的PbA感染小鼠的大脑显示出脑内损伤的证据,包括含有寄生红细胞的血管周围出血(图1d-e),如前所述[18],[ 19]。此外,许多血管被寄生的红细胞组成的血栓广泛闭塞。相反,在用oAC处理的PbA感染的小鼠中未观察到这些组织学变化(图1f)。
促炎细胞因子与实验性和人类疟疾的结果有着长期的联系(综述见[20] - [22])。为了确定oAC是否通过脾CD4 +和CD8 + T细胞影响促炎细胞因子的产生,我们使用多参数细胞内流式细胞术。通过直接离体分析,在产生TNF,IFNγ或IL-17 的CD4 +和CD8 + T细胞的数量之间未观察到差异(数据未显示)。然而,由于细胞因子产生的直接体外分析仅揭示了T细胞功能的快照,并且可能无法完全反映多功能细胞因子应答的能力[23]。,我们还检查了用PMA刺激2小时后的反应(图2)。单独产生IFNγ 的CD4 + T细胞的数量在很大程度上不受oAC处理的影响。然而,与未感染的小鼠相比,未经处理的PbA感染小鼠共同产生IFNγ +和TNF +的 CD4 + T细胞和单独产生TNF的细胞的频率明显增加,而用oAC治疗的小鼠则不然(图2a)。)。对于CD8 + T细胞也观察到类似的趋势,尽管这在产生非IFNγ的TNF产生细胞的情况下仅是显着的(图2b)。CD4 +和CD8 +产生IL-10的T细胞仅在少数小鼠中检测到,不管处理和非常低的丰度(每只小鼠<10 4 ;数据未显示)。总之,与未处理的PbA感染小鼠相比,oAC处理导致CD4 +和CD8 + T细胞中促炎细胞因子产生的承诺减少。
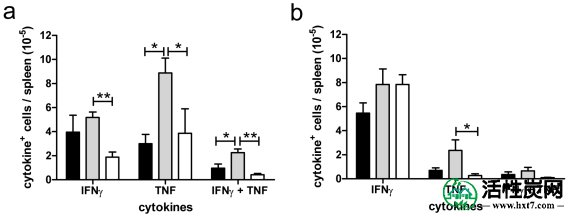
在第6天杀死PbA感染的(灰色条)和PbA感染的oAC处理的(黑色条)小鼠,并在PMA刺激后测量细胞因子。显示了脾IFNγ +,TNF +和IFNγ + TNF + CD4 +(a)和CD8 +(b)的绝对数量。未感染的小鼠(空心条)显示为基线。数据代表平均值±SE(来自2个独立实验的n = 10只个体小鼠)。*,p <0.05; **,p <0.01; ***,p <0.001。
为了确定oAC是否具有进一步可测量的全身效应,我们对全血进行了全基因表达谱分析。实验设计总结在图3a中。用PbA感染20只小鼠,在d3和d5处,10只用oAC(第1组)处理,10只用盐水处理(第2组)。在第6天,在ECM症状发作后但在第2组中发生任何死亡之前,每组中的5只小鼠被杀死,并且处理全血用于基因芯片分析和流式细胞术。5只幼稚小鼠提供血液作为参考('基线')。剩余的感染小鼠用于监测ECM的发展,再次显示oAC显着保护小鼠免于ECM(Fisher's Exact test p = 0.048; RR = 0.2; 图3b))。在用于基因表达分析的取样时,两组小鼠具有相似的寄生虫病,平均体重和T细胞(CD3 +),B细胞(B220 +)和NK细胞(NK1.1 +)的频率,而CD11b 在用oAC处理的小鼠的血液中,+细胞的频率略微降低(数据未显示)。我们确定了与oAC治疗PbA感染小鼠相关的全血特征,由68个基因组成,其错误发现率校正P值<0.05(范围从p = 0.011到p = 1.47e 7)并通过切割 - 相对于未经处理的PbA感染的小鼠,上调或下调2倍(图3c)。该表示显示未处理的PbA感染小鼠的全血表达谱中存在高度相似性。然而,在oAC治疗组中,存在更多的变异性,一些小鼠(最值得注意的是#1.1和较小程度的#1.3)具有与未治疗小鼠更接近的基因表达谱。鉴于在该队列的oAC治疗小鼠的其余部分中观察到对ECM的保护水平(图3b),该分析表明,全血分析可能能够识别治疗失败,但需要进一步的研究来证实这一说法。然而,我们的微阵列和细胞因子分析共同证实,oAC处理对感染PbA的小鼠的免疫和炎症反应具有显着和系统的影响。
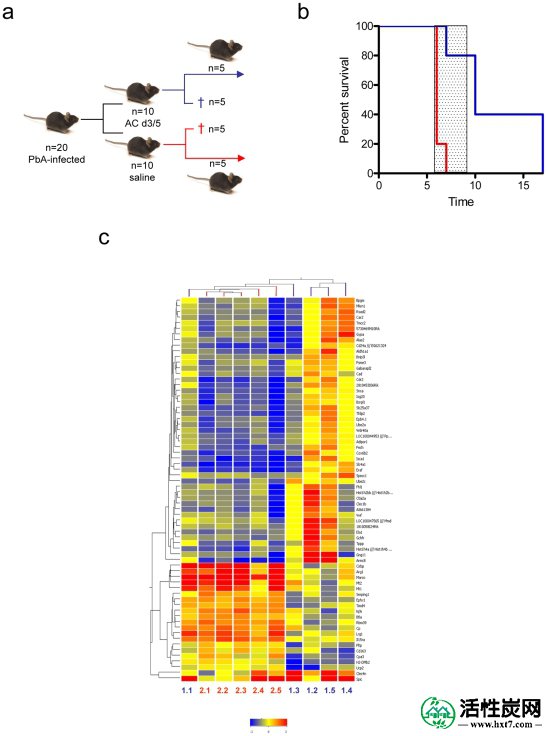
a)用PbA感染20只C57BL / 6小鼠,在d3和d5处用oAC处理10只小鼠。在第6天,每组5只小鼠被杀死用于基因表达分析,并且监测其余的存活。b)与未处理的PbA感染的小鼠相比,oAC处理的PbA感染的小鼠(蓝线)显着免于ECM(红线; p = 0.048)。c)通过68个基因的分级聚类产生的热图,其通过5%的错误发现率的p值阈值,并且在oAC处理的与未处理的PbA感染的小鼠的全血中差异表达> 2倍。显示了基因树(侧面)和样本树(顶部)。个体小鼠在底部编号(oAC处理:1.1-1.5;蓝色文本,未处理:2.1-2.5;红色文本)。还显示了热图强度标度。
如上所述,oAC的保护功效和免疫调节作用支持oAC在治疗人类疟疾中的潜在作用。然而,探索oAC作为严重疟疾的辅助治疗必须考虑到oAC增加奎宁的消除[24] - [26],到目前为止是严重疟疾(SM)的主要治疗方法。认识到奎宁可能被AS替代用于治疗严重疟疾[14],作为重要的第一安全步骤,我们因此试图确定oAC是否改变了肠胃外AS或其活性代谢物DHA的药代动力学。
52名健康成人参加了研究(来自187名筛选的志愿者(图4)。每组的研究参与者在年龄,体重,AS剂量和性别分布方面相似(表S1)。安全且耐受良好。未发生严重不良事件。第1组(AS单独)的一名参与者在给予静脉注射AS后呕吐一次。在生物化学和FBC测试中未观察到与正常范围的临床相关偏差。
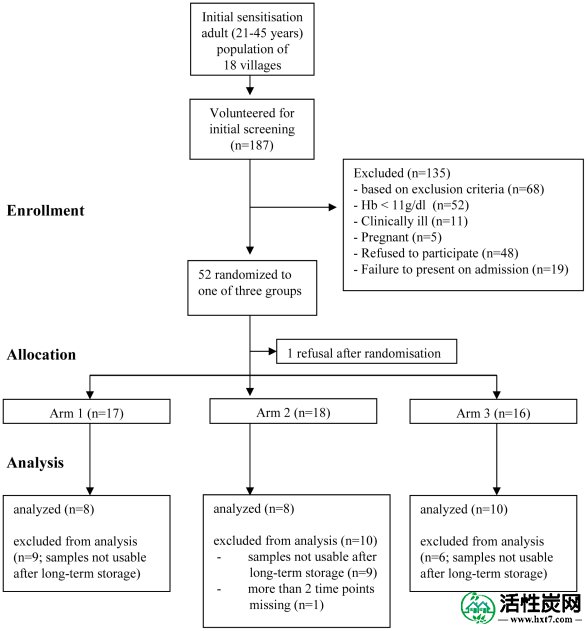
该图表提供了每个阶段的个人数量的信息。括号中的数字表示可以分析AS和DHA的样品数量。
如上所述,评估臂1和2中的8个个体的AS和DHA血浆浓度,以及臂3中的10个个体。图5显示了每个拟合曲线,并且使用该臂的几何平均剂量,通过每个时间点的每个臂的几何平均浓度拟合的一室模型。对于AS(图5a)和DHA(图5b)),三臂之间的几何平均AUC相似。比较曲线下面积(AUC,计算为剂量/清除率)的ANOVA分析显示三组之间没有显着差异(对于AS,p = 0.92,对于DHA,p = 0.55)。与对照相比,四种比较在几何平均值中的最大差异为-17%,其发生在第3组中的DHA。与任何药代动力学参数的对照相比没有达到统计学显着性。对于AUC,四个置信下限的最低值为对照(DHA;第3组)的-43%,上限的最高值为+ 42%(AS;第2组)(表1))。因此,我们无法检测到oAC对AS或DHA的药代动力学的任何影响。即使样本量很小,我们也能够确定对AUC的任何影响都不可能达到50%,与每个臂内个体之间观察到的~200%变化相比,这是一个轻微的影响。
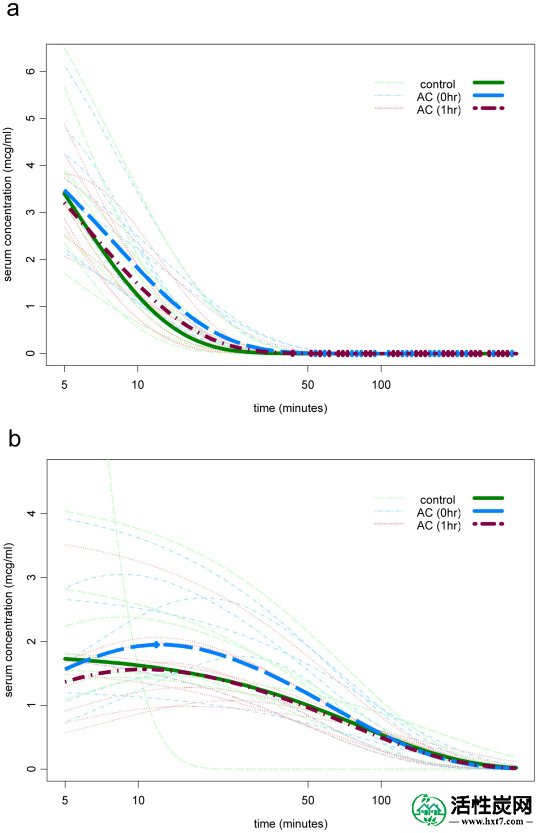
a)AS和b)正常志愿者中的DHA血浆浓度,单独用AS处理(绿色),同时用AS和oAC(蓝色)或用AS处理,1小时用oAC(红色)处理。数据显示为拟合曲线,每个个体使用一室模型(对于第1组和第2组,n = 8,对于第3组,n = 10),并且还作为通过每个时间点的每个臂的几何平均浓度拟合的曲线(重线)。三臂之间的几何平均AUC在统计学上没有显着差异(对于AS,p = 0.92,并且通过ANOVA,对于DHA,p = 0.55)。
| 药物和参数 | AS +水(对照)(n = 8) | AS +木炭同时(n = 8) | 1小时后AS +木炭(n = 10) | ||
| 与对照的百分比差异(95%CI) | 与对照的百分比差异(95%CI) | ||||
| 青蒿琥酯 | |||||
| AUC(min×μg / ml) | 48(23-77) | 49(32-71) | +2(-26,+ 42) | 46(33-67) | -4(-29,+ 32) |
| t 1/2(分钟) | 3.4(1.8-5.2) | 4.1(2.9-5.3) | +21(-11,+ 65) | 4.0(2.6-7.0) | +18(-12,+ 58) |
| CL / F(升/分钟) | 3.1(1.5-5.5) | 3.1(2.2-4.5) | +2(-27,+ 44) | 3.1(2.0-4.3) | +1(-27,+ 40) |
| V / F(升) | 15(7.6-29) | 19(9.2-34) | +24(-22,+ 98) | 18(11-34) | +19(-23,+ 85) |
| DHA | |||||
| AUC(min×μg / ml) | 172(108-310) | 161(91-268) | -6(-37,+ 38) | 142(91-247) | -17(-43,+ 19) |
| t 1/2(分钟) | 34(1-116) | 40(19-65) | +20(-49,+ 183) | 52(32-109) | +53(-32,+ 245) |
| CL / F(升/分钟) | 0.85(0.46-1.27) | 0.95(0.57-1.56) | +12(-24,+ 64) | 1.00(0.53-1.73) | +16(-18,+ 70) |
| V / F(升) | 41(2-113) | 56(30-132) | +34(-43,+ 218) | 75(34-167) | +80(-20,+ 309) |
| C max(μg / ml) | 2.9(1.4-29) | 2.2(1.3-4.1) | -25(-61,+ 45) | 1.7(1.0-3.8) | -43(-69,+ 7) |
| t max(min) | 0.8(0-14) | 0.7(0-27) | -9(-97,+ 2740) | 2(0-24) | +162(-90,+ 6720) |
每年,恶性疟原虫感染导致4至6亿疟疾病例和非洲100万儿童死亡[1]。在这里,我们证明oAC可以保护小鼠免于ECM的死亡,以及T细胞细胞因子产生的相关变化。在全血基因表达谱中。重要的是,oAC治疗后观察到的免疫应答和基因表达谱的变化对宿主对PbA感染本身的保护没有负面影响。。在随机对照开放标签I期研究中,我们发现oAC不干扰目前最好的抗疟疾药物AS的药代动力学。总的来说,这些数据为oAC的临床评估铺平了道路,因为oAC是一种新的安全,有效和可负担的治疗男性严重疟疾的辅助治疗方法。
我们的数据表明,oAC几乎完全抑制了小鼠ECM的临床和组织病理学征象。在那些确实发生ECM的小鼠中,发病被延迟,并且在存活的小鼠中,oAC似乎也提供了一定程度的保护,以防止由于高寄生虫血症导致的死亡,如通过总存活时间所测量的。然而,显然需要进一步研究以了解oAC介导这些显着效应的机制。在慢性肾病中,已经提出oAC用作阻止肠道吸收吲哚的汇,从而限制吲哚硫酸盐的肝脏产生,吲哚硫酸盐是TGFβ产生的调节剂[13]。。其他数据表明胆汁介导的细胞因子通过肠 - 肝途径转移到肠腔的可能性,木炭作为假定的局部吸附剂[12]。
来自当前研究的两个证据表明,oAC对免疫和炎症过程具有广泛的系统性影响。首先,oAC治疗显着减少了能够产生TNF +的脾CD4 +和CD8 + T细胞以及共同产生TNF和IFNγ 的CD4 + T细胞的数量,如再刺激后所确定的。尽管在体外直接测量的细胞因子产生没有观察到oAC的影响,但是这样的观察与血清促炎细胞因子(包括上述测量的那些)在感染中比在我们的分析中使用的时间点更高的报道一致[27]。并且使用其他数据表明在再刺激后检测多功能的能力更强[23]。在已经改变ECM过程的其他模型中已经观察到疾病结果和细胞因子水平之间的类似关联。例如,在对ECM有抗性的MyD88 - / - C57BL / 6小鼠中,IFNγ,TNF和IL-17的产生减少[27]。类似地,在小鼠中治疗其他新提出的辅助疗法,这些疗法显示出相对于ECM的相似水平的功效,如本文所示,对于oAC,包括泛肾[28]和罗格列酮[29],TNF的水平也降低了。对于罗格列酮,在人类中也观察到炎症的抑制和增强的寄生虫清除作为这种药物作为轻度疟疾的辅助治疗(使用atovaquone /氯胍)[30],证实了小鼠疾病模型研究的转化潜力。
其次,微阵列分析鉴定出明确的全血转录特征,其区分oAC处理的和未处理的PbA感染的小鼠。ECM中的基因表达分析以前主要限于使用脾细胞或脑组织[31] - [33],在遗传上不同的宿主或使用不同的寄生虫菌株进行比较。相比之下,在这项技术应用于人类疟疾一直局限于分析PBMC或全血[34] - [36]再次通常比较具有不同疾病结果的个体。据我们所知,在寻求预防严重疾病发展的干预措施之后,没有对基因表达谱进行直接比较。我们的基因表达数据的进一步分析,包括与oAC治疗相关的特征的改进,将在别处发表。然而,此处显示的数据提供了oAC处理直接或间接影响基因调控的证据,如在来自PbA感染的小鼠的全血中测定的。与oAC治疗相关的68个基因的特征包括参与急性期反应和炎症的多个基因,以及参与血红素生物合成和红细胞功能的基因(例如Fech,Epb4.1,和Slc25a37)。开发血液转录生物标志物的案例已在其他地方广泛争论[37],[38],并且最近已经描述了将“模块化”方法应用于SLE患者对治疗的反应的基因组分析[39]。将来重要的是确定相似或不同的签名是否与旨在中断ECM进展的其他干预措施相关联,以及何时评估oAC对人类CM和严重疾病的保护,同样确定此类签名是否具有交叉性 - 物种预测价值。
尽管尚未确定oAC的分子作用模式,但我们认为此处报道的实验数据现在应该为评估oAC作为治疗严重疟疾的基础提供依据。oAC可在不存在替代治疗的情况下提供一线治疗。严重的疟疾是一种急性疾病,可能在发烧后96小时内出现神经系统症状; 这段时间的大部分时间都可能用于从偏远的村庄到健康诊所,因此许多孩子昏迷。如果我们对小鼠模型的观察结果将转化为人类,那么在感染过程中早期给予oAC可以阻止CM的发展并可能降低CM相关的死亡率。值得注意的是,AC在中毒治疗中已使用多年,并且可以口服或通过鼻胃管给药,特别是粉末形式。它具有良好的耐受性,具有优良的,有良好记录的安全性,并且相对便宜。此外,AC具有较长的保质期,可以在环境温度下储存。如果临床疗效得到证实,这些属性将使AC非常适合在偏远的农村社区使用,在那里可以在第一个护理点进行管理,例如由村卫生工作者进行管理,并鼓励有效吸收疟疾中的木炭疗法 - 流行国家。
然而,鉴于可以获得疟疾的特定治疗,并且单独的oAC治疗在小鼠中没有抗疟疾活性,评估口服AC作为独立治疗的功效的直接方法在人类中是不道德的。事实上,进一步探索oAC作为辅助治疗的潜在益处必须考虑到官方建议oAC用奎宁治疗中毒[40],增加对这种药物的消除[24] - [26]。然而,尚不清楚AS的药代动力学,一种现在被认为优于奎宁用于治疗严重疟疾[14]并且已知具有高内源清除率的药物[41],将受到oAC共同管理的影响。当与AS同时给药或1小时后给药时,我们没有发现由于oAC引起的AS或DHA血浆水平降低的证据。在第2组(同时AS和oAC)和3(AS后1小时oAC),个体在开始血浆采样前12小时接受第一剂oAC。在这些组中发现的AS和DHA浓度不低于对照组中观察到的这一事实支持以下结论:即使AS施用时肠中高浓度的AC也不干扰AS的药代动力学。或DHA。尽管该试验没有等效设计,但所有开始治疗的受试者都按照方案计划进行,并且没有救治疗法。这减少了对解释结果的担忧,就好像它们来自等效性试验一样。尽管等效试验所需的样本量不同,但实际获得的样本量(由于未能分析某些样本而减少)当然反映在置信区间的宽度上。因此,这些数据表明,AS和OAC联合治疗疟疾患者的临床试验可以在不影响AS的抗疟疾活性的情况下进行。
最后,由于初级卫生保健一级的资源有限,往往无法可靠地为重病儿童分配正确的诊断,特别是区分疟疾和细菌感染(如肺炎,伤寒/非伤寒沙门氏菌)或脑膜炎)[42],[43]。治疗主要是关于推定诊断的经验,临床评估往往令人不安[44]导致疟疾过度诊断而导致严重的细菌感染[45],[46]。对于成功使用的辅助治疗,无论精确诊断如何,它都需要是安全的并且理想地是有益的。由于其非特异性抗炎潜力,oAC可成为此目的的理想候选者,已成功开发十多年,以预防慢性肾病的进展[13]。
总之,oAC在小鼠模型中预防了与ECM相关的死亡率,并且当给予人时不会干扰AS或DHA的药代动力学。因此,oAC有可能成为治疗严重疟疾的一种易于实施的疗法。我们建议现在迫切需要对照临床试验来评估oAC在人类疟疾中的功效。我们建议oAC开发的下一步应该是评估其安全性,作为无并发症疟疾的辅助治疗,这是最近开发罗格列酮的一种途径[30]在对严重疟疾病例的潜在益处进行评估之前。将基因表达谱分析纳入此类试验还应该进一步深入了解AC在人体中的作用方式。