发布日期:2018-11-15 10:04 来源:活性炭网 作者:活性炭网 浏览数:
碳酸钾是高度吸湿的盐,这一方面对于 从环境空气中捕获 CO 2 变得重要 。 此外, 从环境空气中捕获 CO 2 需要具有非常低压降的吸附剂。 在本工作中,活性炭蜂窝体整料用K 2 CO 3 涂覆
人类正面临着全球变暖效应将在未来带来的后果的不归路。CO 2捕获已经主要集中在发电厂中的应用; 1 - 6尽管如此,在某些情况下,气体预处理捕获单元之前,需要与它对应。7日前,收集CO 2从周围空气中直接收集了很多的关注,在国际社会。8,9它具有使得它与任何种类的CO涉及的优点2无论来源类型如何,这对于来自运输部门的排放尤其重要,因为原地捕获单元是不切实际的。此外,使用CO 2作为后续工艺的原料将使其收获在经济上具有吸引力。可能的应用是CO的产生2富集的空气,可以内部温室被用于增强植物的生长。或者,纯CO 2可用于通过太阳能,即太阳能燃料合成甲醇。
多种选项已经提出了用于捕获CO 2从环境空气,包括交换树脂,10,11微藻,12胺系吸附剂,13 - 18碱性金属系水性和固体吸附剂,19 - 22和金属有机骨架(MOF)。23,24在一般情况下,胺已经被呈现为更具吸引力的吸附剂由于其高的CO 2捕获能力; 但是,已经报道了一些化学或物理不稳定性问题。25 - 27
从环境空气中捕获的CO 2的特征在于需要处理的大量空气,因为其具有讽刺性的非常低的CO 2含量,约400ppm。将大量空气通过反应堆可能会带来操作问题; 例如,使用水溶液的缺点是在空气冲洗过程中损失的水量会变得过高。28此外,反应堆中的压降应尽可能低,因为移动空气所需的功率可能使该过程变得不可行。一个有吸引力的选择是使用蜂窝状整料,因为它们具有很高的表面积,并且具有非常低的压降。Sakwa-Novak等人。29报道了一种由载有聚(乙烯亚胺)的氧化铝整料组成的吸附剂; 当用含有400ppm CO 2的干燥气体混合物处理时,重量负荷为0.3g 胺 / g ads(g ads表示吸附剂克数),最大CO 2捕获容量为0.7mmol CO 2 / g ads。 30°C。
已经研究了K 2 CO 3作为从烟道气中捕集CO 2的替代方案; 已经提出了不同类型的载体材料,其中活性炭,氧化铝和TiO 2表现出最佳性能。30 - 37氧化铝具有使得其形成与盐副产物的缺点。38使用在氧化铝或氧化钇上负载的K 2 CO 3捕获大气CO 2的底漆研究表明,为了保持稳定的吸附容量,再生必须在150℃下进行。20,21
碳酸钾是一种非常吸湿的盐; 它水合物形成碳酸钾倍半水合物,K 2 CO 3 ·1.5H 2 O,由所指示的反应R1。据报道,无水和倍半水合物之间的转变发生在25℃的相对湿度(RH)为6-10%的范围内,39并且进一步增加到高于43%RH,由于潮解导致形成水溶液。40倍两者的碳酸盐,无水的和水合的,很容易发生与CO反应2,形成碳酸氢钾(KHCO 3),如由反应R2和R3(所有Δ ħ来自ref(41)的300 K值:
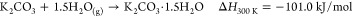
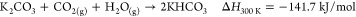

Duan等人的理论平衡计算。图41显示无水碳酸盐比水合物更具反应性。另一方面,考虑到反应的ΔH较低,将KHCO 3再生回K 2 CO 3 ·1.5H 2 O的能量消耗较少。如反应R3所示,可以通过加入水从KHCO 3再生K 2 CO 3 ·1.5H 2 O. 因此,可以提出通过水分摆动过程进行再生步骤。此外,在先前的工作中已经得出结论,在CO之前用H 2 O 处理2吸附有利于从模拟烟道气中捕获CO 2。42,43
在目前的工作中,在用H 2 O 预处理后,测试由涂覆有碳酸钾的整体式活性炭蜂窝(ACHC)载体组成的CO 2吸附剂从环境空气中捕获CO 2.按照实验44的部分因子设计进行研究了吸附温度(T),空气的水蒸气压(P w)和体积空气流速(F)对吸附剂的CO 2捕获能力的影响。最后,提出了在温和温度下进行吸湿剂再生的一个循环,以测试该过程的可行性。
活性炭蜂窝体单块购自COMELT SpA。尺寸为2.9×2.9×3.0cm(11×11通道)的活性炭蜂窝状整料在120℃的烘箱中干燥8小时; 得到的干质量为10.65g。冷却至室温后,将其浸入120g水溶液中,该水溶液以每8g软化水1g K 2 CO 3(Sigma-Aldrich,> 99.0%)的重量比制备。延长浸渍时间,直到溶液中不再释放出气泡。然后,手动摇动整料以除去残留在通道中的所有过量溶液,并在实验装置中在170℃下煅烧干燥的N 2以将所有盐转化为K 2 CO 3。。由制备方法中吸附剂重量的增加计算盐负载量。记录的最终重量为11.28g,其导致盐负载为0.0558g K 2 CO 3 / g 广告(5.58wt%)。
使用X射线衍射,FT-IR光谱,SEM和BET N 2吸附 - 解吸技术分析样品。使用联合委员会粉末衍射标准(JCPDS),将配备有铜阳极X射线管的标准X射线衍射仪(PANalytical X'Pert Pro Powder)用于相鉴定。使用FT-IR光谱仪(配备通用ATR采样附件的PerkinElmer Spectrum 100 FT-IR)获得红外光谱。在SEM显微镜(Jeol JSM-6400)中观察样品。基于使用Micromeretics ASAP 2400装置收集的N 2吸附数据,使用BET理论45和使用BJH理论的孔体积计算活性炭载体的表面积。46
实验装置的图解示于图如图一1。它由方形横截面的固定床反应器(R1)组成,尺寸为5×5×20cm,而气体在反应器底部进料。将板放置在反应器的入口处以分配流动。将吸附剂置于金属泡沫的顶部以进一步确保均匀的流动分布。包裹在铝箔金属泡沫放置吸附剂和反应器,以防止气体旁路的内壁之间(见的右手侧图如图一1)。两个热电偶从反应器的顶部插入并在两个位置处经过蜂窝:在顶部和底部部分,上的右手侧所描绘图如图一1。进料到反应器的气流在从N 2到空气(400ppm CO 2)的实验中变化,无论是干的还是潮湿的。通过使干燥空气在5巴的压力下通过柱C1来制备空气流,柱C1填充有沸石13X珠,其除去其中的所有CO 2。来自塔的流动被分成两个流量,这两个流量通过控制器FC2和FC3控制。通过将这些流中的一个鼓泡通过保持恒温的储水器来添加水。该CO 2(林德,≥99.7vol%)添加由流量控制器FC1控制。在每次实验之前,使制备的气体混合物稳定,同时从反应器R1下方的阀V1离开系统。一旦测量的气体混合物保持稳定,切换阀V1,进料反应器。使用传感器S1(PP Systems SBA-5 CO 2)和传感器S2(Omega HX92A与热电偶耦合)分别测量进料流中CO 2和H 2 O 的浓度。该CO 2用传感器S4(LI-COR LI-820)测量离开反应器的物流中的含量。在两个点测量离开反应器的物流中的湿度:在具有传感器S3的反应器(Omega HX92A与热电偶耦合)之后立即和在通过传感器S5的冷凝系统之后(PP系统SBA-5 CO 2 / H)2 O)。通过流量计FM(DryCal Mesa Labs Defender 520)在排气口测量总体积流速。在整个实验装置中检查CO 2传感器的校准。
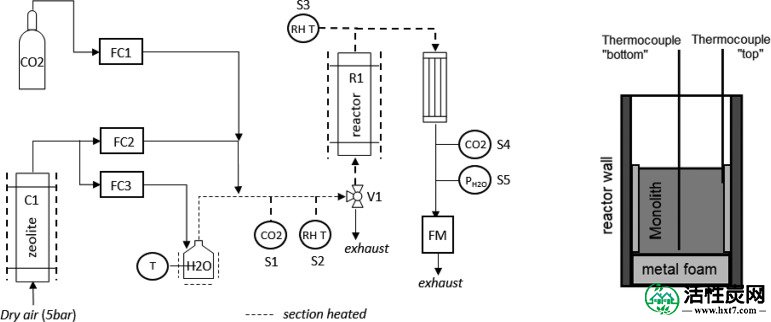
实验装置图(左)和反应器内热电偶的位置(右)。
活性炭载体和吸附剂的吸水量在40℃,N 2流量和不同含水量,高达80%RH下进行测试。进行实验直至反应器出口中的水蒸汽压力等于入口侧的水平。从样品相对于其干重的重量变化计算H 2 O吸收,H 2 O 吸附 [g H 2 O / g 固体 ]。

其中m final是实验结束后测量的样品质量,m dry是干燥样品的质量。
此外,为了确定K 2 CO 3 ·1.5H 2 O的形成,将几毫克K 2 CO 3在烘箱中加热至160℃,然后在40℃下用湿N 2处理,将湿度变化至20%RH。通过FT-IR光谱分析产物以跟踪任何相变。
对于CO 2吸附容量的研究,实验路线包括在170℃下用N 2初始煅烧。然后如下进行循环:吸附剂的加湿,吸附和煅烧。加湿在40℃,5L / min的N 2冲洗下进行,水分含量为P w = 40mbar(53%RH)2小时。水合后,在表1中规定的条件下进行CO 2吸附实验(不按所示顺序)。通过在5L / min的干燥N 2冲洗下在170℃下煅烧来实现吸附剂的再生。据报道,KHCO3快速且完全分解在120°C以上。47
| T [°C] | P 瓦特 [毫巴] | F [L / min] |
|---|---|---|
| 20(-1) | 5(-1) | 5(-1) |
| 20(-1) | 5(-1) | 15(1) |
| 20(-1) | 17(1) | 5(-1) |
| 20(-1) | 17(1) | 15(1) |
| 40(1) | 5(-1) | 5(-1) |
| 40(1) | 5(-1) | 15(1) |
| 40(1) | 17(1) | 5(-1) |
| 40(1) | 17(1) | 15(1) |
| 30(0) | 12(0) | 10(0) |
CO 2吸附容量[mmol / g ads ]计算为
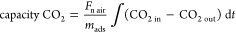
其中F n air是实验装置排气中空气(干燥)的摩尔流速,m ads是吸附剂的质量,CO 2 in和CO 2 out是入口和出口中CO 2的浓度。反应堆,t是时间。
使用不含任何K 2 CO 3的活性炭单块进行空白循环以测试载体对CO 2的吸收。观察到没有捕获CO 2,因为出口浓度立即等于入口值。
根据实验的分数阶乘设计研究了T,P w和F对CO 2吸附容量的影响。测试范围如下:温度为20至40℃,水蒸汽压力为5至17毫巴,空气流速为5至15升/分钟。实验以随机方式进行,以避免依赖于先前运行的条件。中心点对应于每个因子被设定为或接近其中间值的条件; 那些是T = 30℃,P w = 12毫巴,和F.= 10升/分钟。这一点用于研究吸附容量响应中是否存在曲率。通过一式三份地运行中心点来评估结果的可重复性。使用的实验条件列于表1中,并在图S1中的立方图中表示(参见支持信息)。使用Minitab Statistical Software Version 17分析CO 2吸附容量数据。
在水分和温度变化下进行解吸实验。为此,使用6cm长的整料制备更长的吸附剂。制备方法与2.1 节中描述的相同。获得的盐负载为0.052g K 2 CO 3 / g 广告。将吸附剂水合并在30℃和P w = 12毫巴下用15L / min空气(400ppm CO 2)进料。解吸试验在65℃和P w = 75mbar下以4L / min的空气(400ppm的CO 2)进行。)。首先将吸附剂加热至解吸温度,然后切换阀V1。通过在N 2下在170℃ 下进一步煅烧来实现吸附剂的完全再生。
图Figure22示出了活性炭载体,吸附剂,并在40℃和53%RH的水合处理后的吸附剂的X射线衍射图。由于K 2 CO 3 ·1.5H 2 O的反射特性的存在证实了盐在载体上的负载。由于载体中加载的盐量低,解释了这些反射的低强度,5.58wt% 。其余的峰对应于载体中的不同相,例如碳和SiO 2。
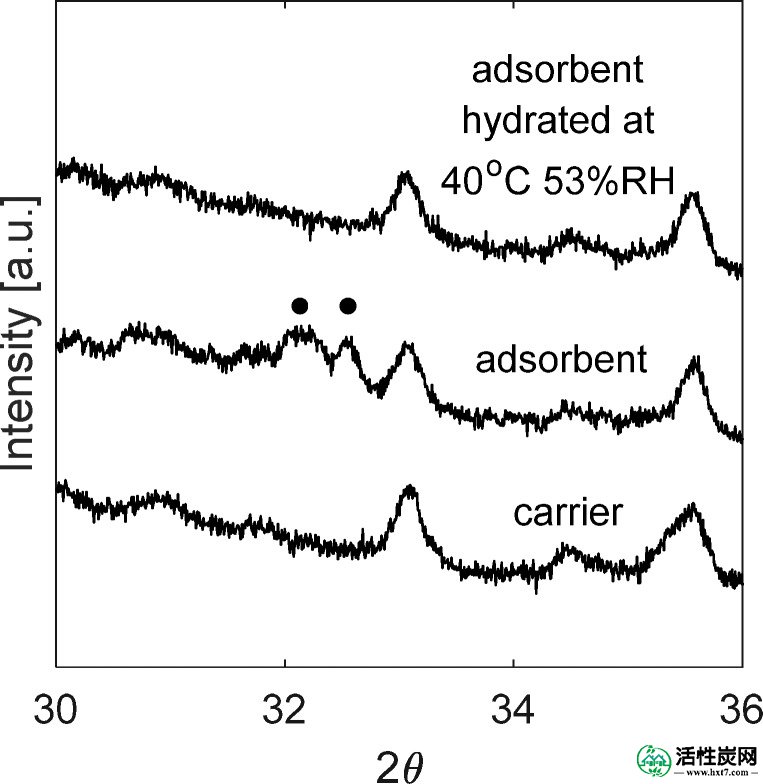
在40℃和53%RH水合后载体,吸附剂和吸附剂的XRD。(●)K 2 CO 3 ·1.5H 2 O.
图Figure33示出了活性炭载体的SEM照片。正如看到的图Figure33一个,该信道是正方形几何形状的具有每边1.979±0.006毫米的长度,并且所述通道之间的壁的厚度是0.651±0.022毫米。图Figure33 2b示出了通道的内壁的表面上; 他们看起来很同质

活性炭载体的SEM照片:(a)通道排列的视图; (b)通道壁的表面。
载体的BET表面积为729m 2 / g。与所计算的微孔体积吨 -plot方法是0.29厘米3 /克,而在直径的范围内的总孔体积为1.7至300纳米为0.12厘米3 /克,与BJH法测定。
据报道,当相对湿度在6至10%RH的范围内并且其在40%RH以上潮解时,K 2 CO 3在25℃开始水合。39后一观察结果与格林斯潘40提出的经验模型一致,表明K 2 CO 3饱和溶液的相对湿度约为43%RH,温度范围为10至30℃。
在40℃下的水吸附容量为载体和吸附剂示于图Figure44。活性炭载体的吸收在60%RH下急剧增加,在80%RH下达到最大23%的重量增加。吸附剂在20%RH下的吸收率为4.1%(重量); 这比载体高3wt%。关于5.58wt%的盐负荷,将K 2 CO 3完全转化为K 2 CO 3 ·1.5H 2所需的吸水量O为1wt%,表明盐完全水合。在44%RH下观察到样品的吸水率之间的最大差异。在那里,吸附剂的吸收量几乎是载体的6倍,并且最重要的是,它远高于理论上形成K 2 CO 3 ·1.5H 2 O 所需的量。这种显着差异的原因是盐在约43%RH下潮解,因此所有过量的水在载体材料的孔中冷凝,产生盐的水溶液。最后,两种样品的水吸附容量在60%RH以上没有很大差异。对于CO 2从实验设计的设计中吸附循环,水合步骤在40℃和53%RH下进行; 这些试验的平均吸水率为12.5%(重量)。图Figure22示出了在40℃和53%RH水合后的吸附剂的XRD; 没有出现对应于K 2 CO 3或K 2 CO 3 ·1.5H 2 O的反射。结论是,用H 2 O 处理在载体材料的孔中产生K 2 CO 3水溶液,失去晶体结构,使其在衍射图中不可见。
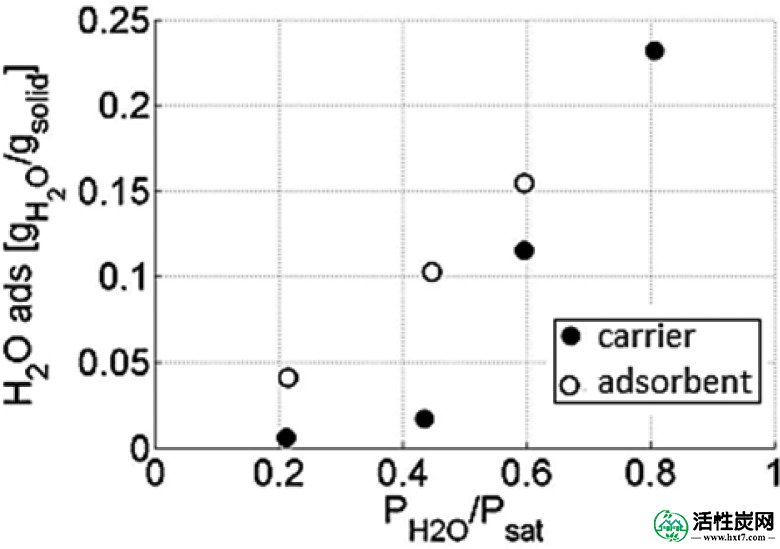
载体和吸附剂在40℃的不同RH下吸水。
通过红外光谱研究盐水合作用。图Figure55示出了K的光谱2 CO 3在40℃的N吹扫下经受不同的相对湿度条件下的样品2。值得注意的是在160℃下在空气中干燥样品呈现只有对应于无水碳酸根离子的峰,CO 3 -2:外的平面在879厘米弯曲-1,非对称伸缩在1400厘米-1,和面内弯曲在686 cm -1。48当盐经受增加的湿度条件时,光谱发生显着变化。在7%RH下,仍然存在对应于无水碳酸盐的初始峰,尽管1400cm -1处的最强峰现在是肩峰并且在1449,1350,1060和704cm -1处出现新峰。尽管不可能分配与这些信号中的每一个相对应的振动类型,但它们都落在可以看到C-O振动的范围内。特别地,已经发现,由于碳酸根离子的对称性的变化,仅水合碳酸盐在1060cm -1附近显示出峰值。49此外,在3000 cm -1处出现宽峰由于水的振动模式。随着相对湿度的进一步增加,来自无水碳酸盐的1400cm -1处的峰在20%RH下完全损失。
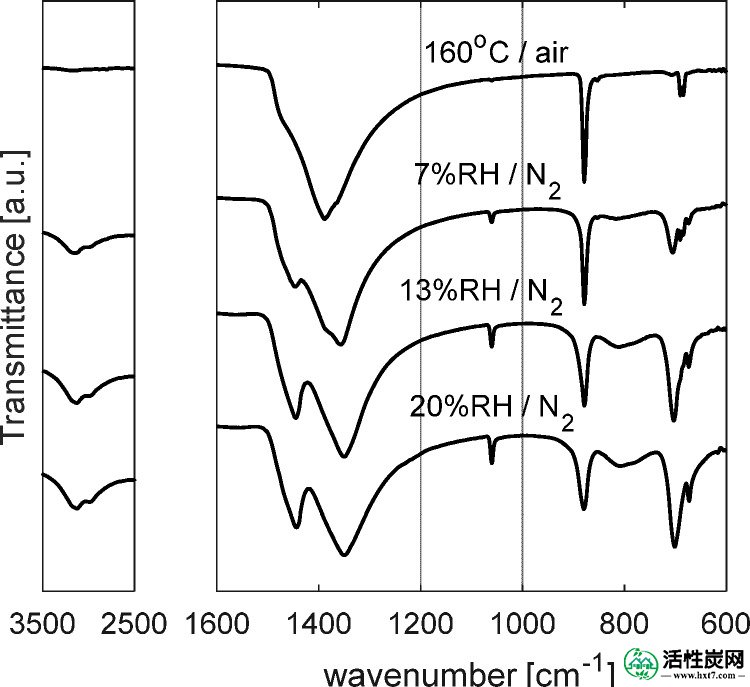
干燥K 2 CO 3的 FT-IR光谱和在40℃下N 2中不同相对湿度下的FT-IR光谱。
一旦水合处理完成,就在特定温度和相对湿度条件下向反应器中加入模拟环境空气和400ppm CO 2的气流。图Figure66示出了CO 2突破为中列出的实验表1,除了中心点一式三份。值得注意的是,对于两种吸附温度,线路根据流速配对。5L / min 的CO 2捕获达到出口中的最低CO 2浓度。这个较低的出口CO 2浓度是气体在反应器中停留时间较长的结果。看着在40℃下进行的实验中,在所示图Figure66 B,那些具有执行P 瓦特 = 5毫巴在两步吸附过程的形式呈现奇数形状。在6.4 节中更详细地讨论了这种行为的原因。

在(a)20℃和(b)40℃下实验的CO 2突破。
为了使不同的吸附实验的累积CO之间的直接比较起见2吸附容量以绘制图Figure77。在那里,线的斜率定性地显示了CO 2被吸附的速率。同样,根据使用的流速,线在前15分钟内配对; 通常,当流速为15L / min时,吸附剂在80-120min后饱和,当流速为5L / min时吸附剂需要150min以上。

在(a)20°C和(b)40°C下吸附的累积捕获能力。
图Figure88示出了用于不同测试的吸附容量。对于在20℃和 P w = 5mbar下进行的实验,达到0.249mmol CO2 / g ads(61.6%盐转化率)的最高吸附容量,并且其与流速无关。另一方面,在20℃, P w = 17mbar和15L / min下获得0.143mmol CO 2 / g ads(35.4%盐转化率)的最低吸附容量。据赵等人在此前的一篇文章中报道过。50表示由活性炭颗粒组成的吸附剂,负载有4.43wt%的K 2 CO 3,在10 000 ppm的CO 2下,在20℃下完全转化为KHCO 3,P w = 20mbar 。这表明CO 2分压对总盐转化率的影响。此外,我们的吸附剂的捕获能力低于Sakwa-Novak等报道的0.7 mmol CO 2 / g 广告。29为其胺基吸附剂。然而,活性化合物负载量的差异也很显着:聚(乙烯亚胺)为30.5%(重量),目前K 2 CO 3为5.58%(重量)。基吸附剂。在这项工作中,不可能在活性炭载体上达到更高的盐负荷,因为这导致相当不稳定的吸附剂在几个循环后被破坏。此外,它不是这项工作的最终目标,以达到最高的CO 2捕集能力,但调查的基本机制和各种参数对CO的影响2捕获性能。当然,更强大的运营商应该允许更高的捕获能力; 增加盐负荷是未来工作所需的主要改进之一。
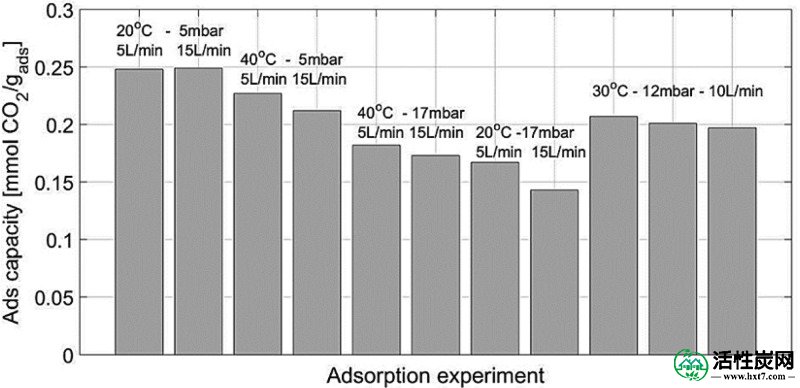
从设计实验设定的CO 2吸附能力。
中心点的三次重复显示,对于第一次,中间和最后一次实验,容量分别为0.207,0.201和0.197mmol CO 2 / g 广告,表明吸附剂损失了其初始值的4.8%。容量。这种容量损失可能是由于在破碎成非常细小的灰尘的形式中观察到的一些物理劣化。
使用Minitab Statistical Software version 17进一步分析吸附容量数据,以确定T,P w和F因子的影响以及它们之间的任何相互作用。输出是用于预测给定T,P w和F条件组的吸附容量的统计模型。标准化或编码单位中的拟合方程(E1)(编码单位分别将-1,0和1设置为给定因子的最低,中间和最高值)
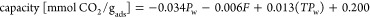
标准偏差为0.006mmol CO 2 / g ads(这表示测量的最低吸附容量的4.2%),并且R 2为97.85%,表明良好的拟合。如从等式E1所见,捕获容量由P w,F和交互TP w定义。系数的符号和大小表明水蒸气压对容量的负面影响最大,流速只有轻微的负面影响。温度 - 水压相互作用对捕获能力具有积极影响。需要指出的一个重要方面是没有温度本身的术语,因为可以预期,由于化学平衡的移动,它应该对CO 2捕获具有最大的负面影响。此外,与之前的工作相反,增加P w对捕获能力没有有益的影响。42,51,52
图Figure99示出了主效应图对于每个所研究的因素; 捕获容量在测试条件的窗口中线性变化,因为中心点一式三份的平均值落在线性模型预测的线中。
捕获容量数据的主要效果图。
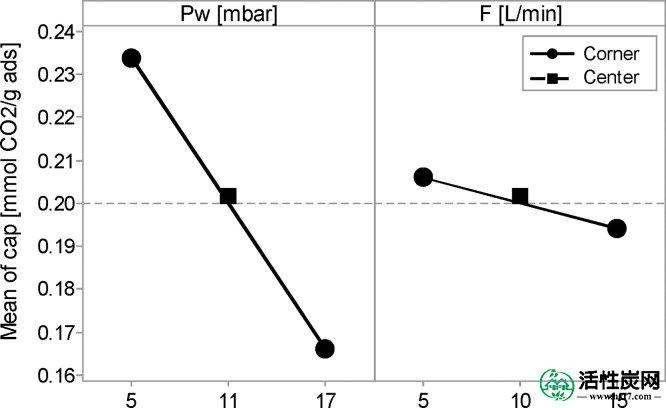
关于这些因素之间的相互作用,只有T - P w具有相当大的影响,而T - F和P w - F没有明显的影响。图Figure1010示出了Ť - P 瓦特交互作用图,其中相反的行为可以在较低和较高的可见P 瓦特。在高P w时,捕获能力随温度而增加; 另一方面,在低P w时它随温度降低。尽管如此,P值较低w对任何温度都有更好的吸附性能。
T - P w捕获容量数据的交互图。
似乎相当不一致的是,较高的温度可能以某种方式导致更好的CO 2捕获性能。可以预期,对于放热过程的化学平衡,例如CO 2吸附,温度的升高对转化是有害的。然而,在20和40℃下重复P w = 17毫巴的实验和两种流动都得到了相同的结果。为了阐明这种趋势的原因,以及统计模型中每个系数的大小,在整个实验中P w和T的演变以及F的影响将在下一节中详细讨论。
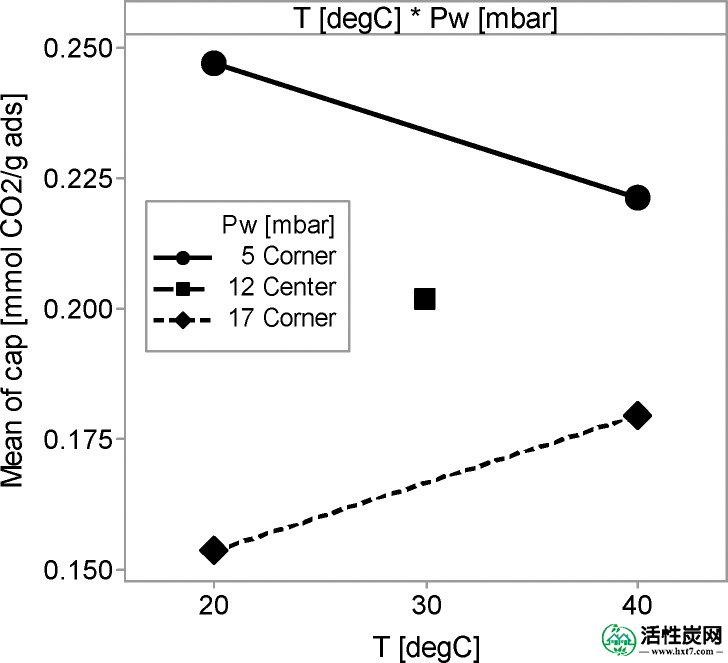
吸附实验期间,在反应器的出口处测量的水蒸汽压力示于图Figure1111。可以看出在图Figure1111 B中为在40℃下进行的所有实验中吸附剂蒸发的水进入空气流作为出口处的水分含量比为5或17毫巴的入口水平。对于在20℃进行的实验C,图Figure1111示出了,在P 瓦特 =发生5毫巴的水蒸发,而在P 瓦特 = 17毫巴的轻微摄取可以注意到。
在(a)20℃和(b)40℃ 的CO 2吸附实验期间,在反应器出口处的P w。
为了解释每个实验中的行为,可以提出四种可能消耗或释放水的子过程; 其中三个与钾盐有关,第四个与活性炭载体有关。与盐有关的那些是(i)根据盐水溶液的水蒸气平衡吸附或蒸发水,(ii)由于K 2 CO 3 ·1.5H 2 O 的碳酸化而释放水,如在反应R3中表示,和(iii)从K 2 CO 3 ·1.5H 2的脱水中释放出水O.关于活性碳的载体,(ⅳ)摄取或取决于其水吸附平衡,在所示的水释放图Figure44。
关于列出的第一种方法,可以得出结论,在53%RH下的水合预处理导致在孔中形成盐的水溶液。由于该溶液的饱和压力为43%RH,如果供应的空气流具有较低的相对湿度,则溶液将蒸发H 2 O以抵消这种情况。对于在40℃和20℃和P w = 5毫巴下进行的所有实验都是这种情况。这也解释了为什么在20℃和17毫巴下进行的实验没有蒸发任何水,因为这相当于74%RH。该蒸发产物为K 2 CO 3·1.5H 2O,条件是相对湿度不低于倍半水合物的蒸气压。应该注意的是,从一开始就存在的盐的水溶液也可以捕获CO 2。关于所提到的第二和第三种方法,即使确实捕获了CO 2,在K 2 CO 3 ·1.5H 2O 的碳酸化过程中释放的水量仅为每两个捕获的CO 2中的 1mol H 2 O. 因此,即使在从气流中除去所有CO 2的情况下,也只有0.2毫巴的H 2 O(200ppm)会释放到其中; 配置文件显示更大的水释放。K不太可能2 CO 3 ·1.5H 2 O脱水,因为在所有实验中相对湿度均高于10%RH,除了实验在40℃和P w = 5mbar,约7%RH下进行的情况。这些情况的CO 2突破显示了两步吸附过程,这归因于K 2CO 3 ·1.5H 2 O 的脱水。在任何情况下,吸附实验期间释放的水量远大于水。通过倍半水合物的完全脱水释放。
结果似乎与先前工作的发现相矛盾,因为在吸附过程中较高的P w导致更好的CO 2捕获性能。31,42,43个这些研究包括K的预处理2 CO 3 / AC吸附剂与水,从而导致盐的转化成K 2 CO 3 ·1.5H 2 O,然后将CO 2的混合物在CO进行捕获2含量高于400 ppm。乍一看,似乎矛盾的是增加气流中的水含量将有利于倍半水合物的碳酸化。实际上,这已经通过化学反应(R3)表明,其中水位于右侧,抑制碳酸化。已经提出,较高的湿度导致形成准液体界面,这增强了反应物的输送并因此有利于碳酸化。53
原则上,CO 2吸附是放热过程; 然而,可以预期,热量的总体演变将通过吸附剂中水的吸附或解吸来确定。这是由于,这发生在一个更大的程度,但平行于CO 2捕获。图Figure1212示出了在“底部”和“顶部”位置处测得的温度。观察左侧的图表,在20°C下进行实验,只有P w = 5 mbar的实验显示出约3°C的轻微初始冷却效果,然后温度缓慢升高直至设定点。相反,实验用P w进行= 17毫巴表示初始轻微的温度升高,然后降低直到设定点。这些温度与演进的趋势匹配良好P 瓦特中所示的反应器的出口图Figure1111。冷却与水蒸发有关,轻微变暖是由水的吸附引起的。关于在40℃下运行的实验中,描绘的右侧图Figure1212,冷却效果在所有情况下发生的。在温度的最大降幅约8℃的,被认为是用于P 瓦特 = 5毫巴和大约5℃的温度降低为P 瓦特= 17毫巴。与20°C实验相比,这种较大的温降是由于水的蒸发速率在40°C时比在20°C时快得多。此外,吸附剂在通道入口处开始冷却,如果该流的相对湿度尚未达到43%RH,则吸附剂将沿着通道长度沿流动方向保持冷却,从而产生温度分布看到。
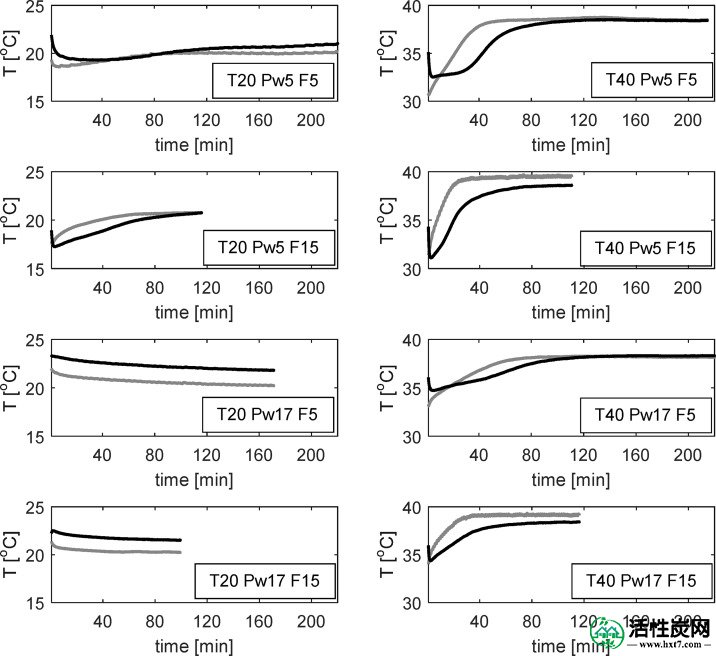
在CO 2吸附期间反应器中的温度分布。左侧:20°C。右侧:40°C。灰线:“底部”位置; 黑线:“顶部”位置。
这种冷却效果也可以解释为什么温度没有出现在统计模型中。进入空气的相对湿度条件决定了水是否会从吸附剂中蒸发,并且该过程局部地调节温度。所述Ť - P 瓦特相互作用缓冲器更高的入口温度的效果。这是吸附剂的一个相当重要的特征,因为它使得可以在温暖的地方从环境空气中捕获CO 2,其中局部温度原则上可能对该过程不方便。例如,在实际应用中,建议通过将KHCO 3转化回K 2 CO 3 ·1.5H 2来再生吸附剂。O和通过水分循环过程进一步形成水溶液,因此导致装载有过量水的吸附剂在随后的吸附步骤中起到冷却剂的作用。
尽管如此,这种冷却效果并不能解释为什么P w = 17 mbar 的实验在40°C时比在20°C时表现更好。为了解释这一点,需要考虑更高温度对气态混合物中组分扩散的影响。对于40℃下的实验而言,吸附剂的局部冷却比20℃时大得多。因此,吸附剂的表面的这些实验中的温度差异不20℃,但在以下所示的图Figure1212。可能是吸附剂的表面比热电偶测量的更冷,因为它们被插入整个通道; 即,它们不直接在吸附剂表面上。因此,有可能是CO 2紧邻吸附剂表面的浓度,即中间相,在这些实验中不是很明显。但是,大部分气流中的温度应该更接近设定点条件。然后,来自大部分气体的CO 2的扩散将受到较热的整体温度的支持,54最终增强CO 2捕获。
流速对统计模型(E1)中包含的所有参数的影响最小。据报道,增加流速有利于以更快的速率获得更高的吸附能力。然而,在一定流量以上,吸附容量再次下降。这归因于气体与吸附剂表面的较短接触时间以获得较大的流量。42,43,55
在40℃和P w = 5毫巴的实验中观察到显示两步捕获曲线的CO 2穿透曲线; 那些对应于约7%RH的相对湿度。然而,反应器内部存在大的温度下降,局部地增加了相对湿度。在图Figure1313从在“底部”和在反应器内的“顶部”位置处测得的温度算出的相对湿度作图针对CO的衍生物2在出口浓度。示出了导数而不是浓度本身给出了变化的中的CO更好的印象2吸附性能。观察到衍生物从实验开始下降并在达到40分钟之前再次上升,表明CO 2吸附的再活化。拐点处的相对湿度分别在“底部”和“顶部”位置为8.8%RH和10.8%RH。有人提到,先前的理论研究表明,无水K 2 CO 3与CO 2的反应性更强。41这两个步骤的行为表明K的脱水2 CO 3 ·1.5H 2 O. 图Figure1414示出了在40℃和53%RH的N水合吸附剂的衍射图如图2所示,在40℃和7%RH的N 2中进行后续处理后,证实了无水K 2 CO 3的形成。为了支持该假设,在相同条件下进行吸附实验,但没有预先水合吸附剂。图Figure1515示出了CO 2未水合样品的突破是一个单步工艺反应发生的是K的直接碳化2 CO 3。
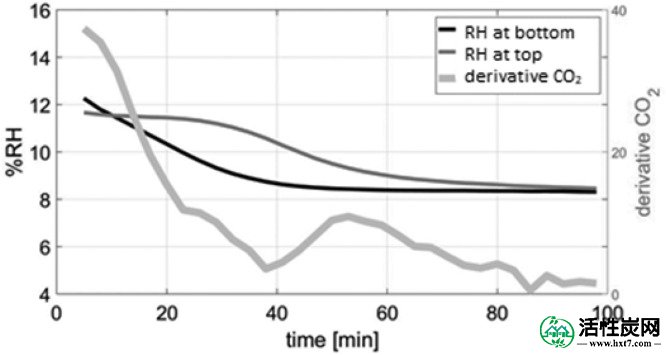
反应器内的相对湿度和出口中CO 2的衍生物。
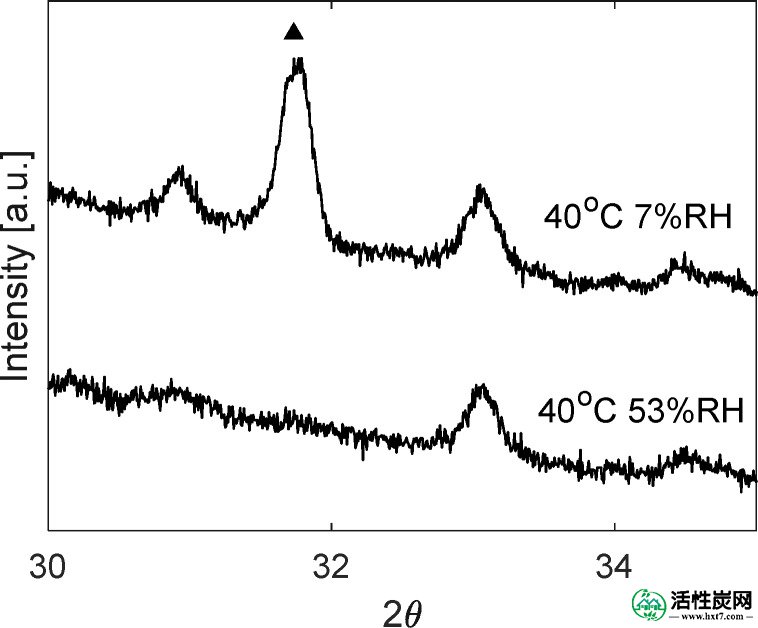
吸附剂的XRD在40℃和53%RH下水合,并在40℃和7%RH下暴露后,均在N 2中。(▲)K 2 CO 3。
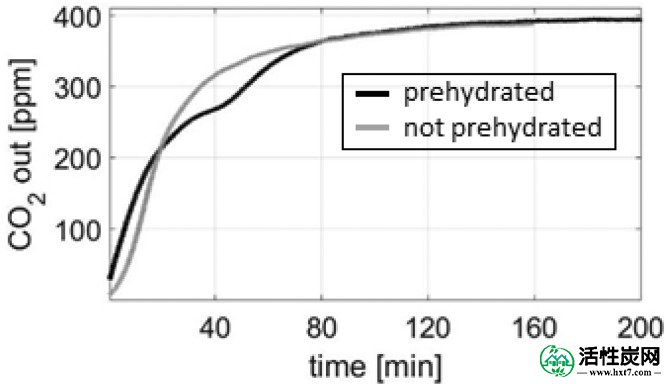
在40℃,P H 2 O = 5毫巴,和5升/分钟时CO 2穿透。
应该注意的是,没有通过水合K 2 CO 3捕获CO 2的独特机制。根据所进行的实验,盐的水溶液沉积在载体的孔上。该溶液的一部分作为CO 2吸附剂,另一部分蒸发,留下K 2 CO 3 ·1.5H 2 O.如果进入的空气的相对湿度低于倍半水合物的稳定性水平,则将其干燥至K. 2 CO 3。K 2 CO 3 ·1.5H 2 O和K 2 CO 3在测试的T和P w范围内,也能够捕获CO 2。
最后,通过在温和温度下的水分回转进行解吸实验,以使KHCO 3再生回K 2 CO 3 ·1.5H 2 O.在升高的温度和N 2流下的再生步骤将具有大的能量损失,使这个过程在经济上不可行。解吸实验在65℃和P w = 75mbar下在4L / min 的空气冲洗(400ppm的CO 2)下进行。该方法允许获得可用于温室的富含CO 2的空气流。图Figure1616示出了CO 2浓度峰值刚好低于5000 ppm。质量平衡表明,在实验中释放了捕获的总CO 2的 50%。尽管最大CO 2浓度对于实际应用来说不够高(例如,1%CO 2),但该实验证明了在K 2 CO 3 ·1.5H 2 O和KHCO 3之间循环的概念。需要进一步优化解吸过程。
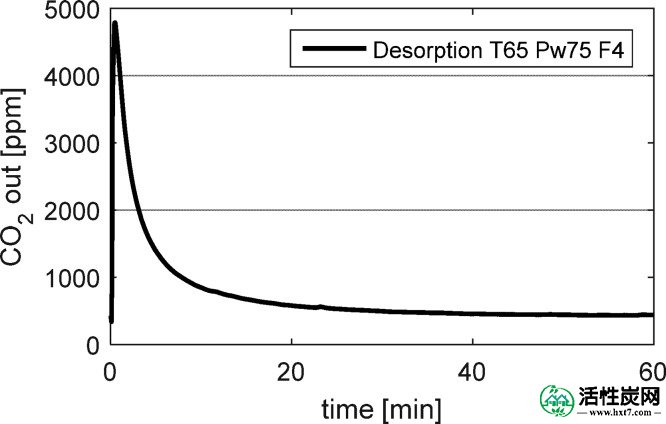
在F = 4L / min空气和400ppm CO 2下,在65℃和P w = 75mbar下进行解吸试验。
结果表明,使用由负载在活性炭蜂窝体上的碳酸钾组成的吸附剂可以从环境空气中除去CO 2。取决于相对湿度,负载的碳酸钾从环境中获取水分,产生碳酸钾倍半水合物或载体孔内的水溶液。从在CO 2吸附之前进行的水合处理,形成能够捕获CO 2的水溶液。该溶液将向K 2 CO 3 ·1.5H 2 O或K 2CO 3蒸发如果进入的空气的水蒸汽压力低于其相应的平衡水蒸汽压力。该蒸发引起吸附剂中的局部冷却,这有利于CO 2吸附。通过多因素设计实验研究了吸附温度,空气含水量和空气流量对CO 2捕获能力的影响,表明水蒸汽压力影响最大。获得的最高捕获能力为0.249 mmol CO 2 / g 广告 ; 然而,盐负荷仅为0.0558克K 2 CO 3 / g 广告。由于在较高负载下载体的物理劣化,盐含量保持相当低。更坚固的载体应允许更高的盐负载量,从而获得更高的捕获能力。最后,在65°C和75毫巴的水蒸气中水分摆动的完整吸附和再生循环产生的峰值CO 2浓度为约。5000 ppm,使其成为温室应用的有吸引力的选择。