发布日期:2018-11-12 09:44 来源:活性炭网 作者:活性炭网 浏览数:
在 原位 用活性炭(AC)水生沉积物修复的基于薄层覆盖是一种很有前途的替代传统的方法,如沉淀物疏浚。 在沉积物中直接使用AC等强吸附剂可以大大降低有机污染物的生物利用率。
用活性炭(AC)和其他吸附剂进行薄层封盖是一种有前景的污染沉积物原位修复方法。它依赖于疏水性有机污染物(HOC)对吸附剂颗粒表面的高亲和力。由此产生的吸附强度足以显着降低污染物的生物利用度和流动性,从而限制其吸收到生物体中并从沉积物释放到水相中。1与传统的修复方法相比,基于AC的修复的成本和劳动力要求通常较低,例如用沙子或粘土等非活性材料进行疏浚或封盖。此外,这些传统方法可能导致严重破坏,导致当地底栖生态系统恶化。2,3
AC薄层帽的修复潜力已在各种实验室试验中得到明确证实,HOC生物累积和沉积物对水通量的降低超过90%。4 - 6关于修复方法的现场试验主要集中在将污染物释放到水柱中,这已被证明已显着减少。7特别是对于长期修复成功,AC封盖已被证明比传统的封盖方法更有效。8现场条件下这种补救方法的生物累积数据不太容易获得。Samuelsson等人。9据报道,用AC薄层帽改良的野外采集的沉积物核心中底栖无脊椎动物对HOC摄取的减少为40%-97%。大多数可用于测量底栖生物HOC体负荷的现场研究利用不同的AC施用方法,其中吸附剂颗粒主动混合到沉积物中。一些研究(田间和半场试验)发现,通过这种混合处理,污染物对底栖生物以及浮游生物群的吸收大大减少。10,11对于薄覆盖层,在初始应用修复潜在可能不是同样高。6从长远来看,但是,底栖生物(生物扰动)的掩埋活动可导致AC颗粒的沉淀物的生物活性层中的类似分散体4,6和因此可比补救效率。
与有关AC修正的修复潜力的有希望的报告相反,一些研究报告了吸附剂材料本身对底栖动物的不利影响。AC引起的这些次级效应的大小取决于受影响的物种,并且已经由Rakowska等人进行了综述。12和Janssen和Beckingham。13最敏感的物种被发现是沉积物栖息生物,例如Lumbriculus variegatus,Chironomus riparius或Arenicola marina。14 - 18在这些生物体的可见效应最通常降低生物质生长或损失,降低的出苗率(C. riparius)或降低喂食率。在少数涉及Gammarus pulex(15)和L. variegatus的高剂量AC的情况下观察到急性毒性(死亡率)。(6)还有报告称底栖动物物种对AC修正案不太敏感,如Neanthes arenaceodentata(19)和Leptocheirus plumulosus。(20)关于野外条件下的不利影响的报告是矛盾的。减少物种丰富度,丰度,并在一些研究中,观察到生物质7,21,而其他人发现的AC修正或没有只有有限的负面影响。22,23
AC修正的长期影响可能受到处理场地沉积的强烈影响。清洁沉积物沉积在AC上的沉积意图并支持修复成功。24它可以通过空间隔离底栖动物从吸附层中进一步减少修正的不利影响,这可能有助于在一些研究中观察到AC应用后海底群落的长期恢复。25但是,这并不总是一个现实的情况。在许多情况下,水体只能部分处理(热点处理),留下污染程度较低的较大区域未经处理。特别是在更湍流的水域中,这些未经处理的位置可以成为污染沉积物的来源,其可以重新沉积在施加的AC薄层帽的顶部。这同样适用于原始污染源保持活动的情况,例如通过向较大水体的扩散输入。Cornelissen等。8发现AC即使被埋在新沉积的污染物质中也能保持其修复效率,并且与传统的修复方法相比具有明显的优势。然而,一般而言,在这种情况下AC的补救潜力的数据很少。
本研究的目的是评估AC薄层帽在次优环境条件下的沉积物修复的适用性,例如上述频繁的动态沉积物运动。现场和实验室试验的结合可以进行彻底和现实的评估。选择测量参数以反映方法的风险(不利影响)和益处(补救潜力)。
该研究的核心部分是芬兰第一次基于AC的沉积物修复的现场试验,该试验于2015年8月在受PCB污染的Kernaalanjärvi湖中建立。(60°85'44''N,24°64'21''E)。1956年至1984年期间,位于湖泊支流Tervajoki河的造纸厂连续排放多氯联苯油是最初的污染源。湖中沉积物的PCB负荷在空间上是异质的。根据1999年的一项研究,湖泊南部(支流河口所在地)的测量浓度从4.2到10.7毫克/千克不等。26大的表面积(4.448公里2该湖泊与其较浅的深度(试验场周围约1米)相结合意味着沉积物经常受到风引起的水湍流的影响。对AC薄层电容器长期成功的潜在影响是本研究的核心问题之一。这方面的两个主要因素可能是上述从湖的未处理区域重新沉积污染物质,以及在施用后盖子的稳定性。
田间试验的设置,300米2在湖Kernaalanjärvi(南部(10米×30米)试验区地图S1粘土(1:)与约千千克选自由AC的按压SediMite粒料的修正:1)混合物(通过湿筛分测定的AC粒度分布:69%<100μm; 25%100-200μm; 6%>200μm)。在5米×5米的子图中手工施用颗粒以确保均匀的扩散。这等于预期的AC剂量为1.6kg / m 2尽管由于水柱内漂移导致吸附剂颗粒损失,预计实际达到的剂量会降低。AC与粘土混合物的应用带来三大优势。首先,简化了吸附剂颗粒的应用,因为粘土增加了吸附剂材料的体积,增加了其密度,从而使压制的颗粒更快地通过水柱下沉。这使得能够从水表面施加粒料,尽管由于粒料的快速崩解而限制了对浅区域的使用。此外,已经表明,向AC添加粘土可以增加薄层帽的长期稳定性并降低其对底栖动物的不利影响。6,7 修正方法的成功(形成均匀的薄层帽)由AC修正后1天从整个绘图区取得的沉积物芯控制。
在AC修订后的2个月,10个月和14个月进行了现场试验的监测。从图中取出沉积物核心以视觉检查AC薄层帽随时间的发展。为了评估AC材料本身的不利影响及其修复潜力,在Kernaalanjärvi湖共有6个地点进行了底栖动物调查:两个地点位于AC修正地块(地块中心的PL-1; PL)距离地块(地图S1)距离(距参考地点2)和距离地图相同距离(约75米)的四个周围参考地点(参考1至参考4))。每个站点的分析参数是分类群丰富度,丰度和生物量(不利影响),以及PCB体负荷(补救潜力)。将前三个参数标准化为从相应位点收集的沉积物的总质量,并将PCB体负荷调节至收集生物体的沉积物中的背景浓度。由于生物样本量不足,无法进行PCB体负荷的脂质标准化。然而,取样的生物主要是摇蚊科或Oligochaeta,它们都具有相似的最小脂质含量(约1%的生物体湿重)。6,27背景PCB浓度标准化为沉积物的总有机碳含量(TOC)。每个站点取一个沉积物子样本,测定沉积物干重(dw)含量,TOC和黑碳(BC)含量(n = 3)。对于TOC测量,用1MH 3 PO 4从样品中除去无机碳,并用0.1MK 2 Cr 2 O 7化学氧化BC样品。28个将制备的样品与N / C分析器进行分析(耶拿N / C 2100,耶拿,德国)。两个月的抽样仅限于PL-1和Ref-1站点。
散装沉积物样品使用4-5埃克曼抓斗(0.122-0.153米收集2储存在4℃,并用于主海底动物调查7天内处理;深度大约5cm 5-9公斤湿重)。将样品过筛(400μm),将生物分成分类组,计数并称重湿重(ww; SI-234分析天平,Denver Instrument,Bohemia,NY,USA)。选择以下分类组作为最低分类水平:摇蚊科,Oligochaeta,桡足类,Hirudinae,Hydrachnidia,Gammeridae和Trichoptera。此后,将含有足够生物量用于PCB提取的生物样品冷冻(-20℃)并储存用于以后的PCB分析。
为了增加可用于PCB分析的生物量,在10和14个月采样期间使用沉淀泵收集更大量的表层沉积物。这些生物仅用于PCB测量(除上述生物之外),并且未包括在底栖动物调查中以维持单一取样方法。将样品原位筛分(400μm)并与当地湖水一起储存,直到在实验室中进一步处理,其中收集生物(摇蚊科),称重ww,并冷冻(-20℃)。
为了监测沉积在AC图上的新材料的数量和质量,在AC施加后1天安装了三个沉积物捕集器。陷阱由两个浸没的PVC管(直径105毫米)组成,漂浮在大约100毫米。沉积物上方50厘米。在设置后10个月和14个月的每次现场访问中,检索到一个陷阱,而第三个陷阱丢失。取出后,将所含的沉淀物转移到玻璃罐中并使其沉降。然后弃去上覆的水并称重沉淀物(ww)。另外,测定材料的dw含量,TOC和BC(n = 3)。
为了评估上述动态沉积物再分布的影响,进行了一系列实验室测试以研究其对施加的AC薄层帽的不利影响和修复潜力的影响。测试在微观世界中进行,基础沉积层被AC帽覆盖。处理包括覆盖AC的不同厚度的沉积层(图S1)。作为参考,测试中包括仅含有沉淀物的未处理的对照微观世界。来自Kernaalanjärvi湖的天然PCB污染沉积物(采样点Ref-1的区域,见地图S1)在实验室试验中用于两个层,以创建现场场景的简化但准确的复制。沉积物dw含量和TOC由子样品(n = 3)确定。
在将沉积物的基础层添加到玻璃容器中并用人造淡水(pH 6.5-7.5)覆盖之后,使用移液管将29粉末AC(粒度<100μm)作为浆料施加以形成薄层盖(剂量) :1.2 kg AC / m 2)。尽管使用比现场稍微更细的AC材料,但是如果AC颗粒尺寸低于200μm,则发现不利影响和修复潜力具有相似的幅度。6交流盖沉降后,顶层沉积物采用相同的方法施加,剂量范围为1.3至63.5 kg / m 2(沉积物ww),其厚度等于1至40毫米。使用的实际剂量范围取决于测量的参数和使用的测试生物。表S1中给出了每种测试装置中应用剂量和所得层厚度的详细概述。
选择两种不同的底栖物种进行试验:oligochaete Lumbriculus variegatus和摇蚊幼虫摇蚊(Chironomus riparius)。虽然两种生物都是沉积物居民,但是L. variegatus通常栖息在比C. riparius幼虫更深的沉积层中。这两个物种在许多淡水生态系统中都非常重要。它们广泛用于沉积物生态毒理学测试,因为它们易于操作并且具有全面的测试指南。30,31为用于本研究的实验生物体内的饲养方法之前已经描述(对于C. riparius在Waissi-Leinonen等人32和用于Abel等人的L. variegatus。6)。
所述C. riparius试验是用第一龄幼虫,起始于1-3天孵化后的曝光进行的。将卵囊从饲养培养水族箱转移到含有人工淡水的玻璃烧杯中,并每天监测以确定孵化日期。用于暴露的实验微观世界设置在1L玻璃烧杯中并含有40只幼虫(n = 3)。这种设置允许的最小一个2厘米2的每个幼虫沉积物表面积所推荐的OECD指南。31测量的终点是PCB生物累积,生长(最终生物量)和暴露时间为12天的存活率。该时间跨度是在初步实验的基础上设定的,以允许最大暴露时间而没有任何个体达到其成年阶段的风险。在实验的最后一天,将存活的幼虫从沉积物(200μm筛)中筛出,计数,并转移到清洁的人造淡水中以使其肠内容物脱水6小时。然后使用细级(Analytic AC 210 P,Sartorius,Göttingen,Germany)将生物体称重ww,并在-20℃下储存在10mL试管中用于随后的PCB提取。
L. variegatus测试的测量终点是在28天的暴露时间内生物量和PCB生物积累的变化(n = 3)。顶部沉积层厚度的使用范围(表S1)延伸至还包括覆盖AC帽的较厚层,因为初步测试显示L. variegatus与C. riparius相比具有更深的居住活动。在将生物体添加到微观世界之前,将它们称重以获得初始生物量(ww)并在人造淡水中适应过夜。在暴露期的最后一天,将蠕虫从沉积物(200μm筛)中取出并转移到清洁的人造淡水中8小时,使它们清空它们的内脏。然后将生物体称重(ww)到10mL试管中并储存在-20℃下用于随后的PCB提取。
在整个实验中使用精细研磨的TetraMin悬浮液喂养C. riparius幼虫。这种外部喂养需要允许C. riparius在实验室微观世界中存活,但应限制在尽可能低的水平,以减少其对测试结果的影响。330.25克德彩/幼虫/天的饲养水平被发现是最佳的实验条件(预备试验)。不需要喂养来支持L. variegatus。
对于从底栖动物调查中获得的样本,Jones等人描述的改进的微尺度方法。由于样品的生物量非常低,因此使用了34。的预先称重的组织(<100毫克湿重)在5mL均化ñ -己烷与超声波仪6分钟(重复两次)。用硅胶柱色谱法35清洗萃取物,然后根据US EPA方法3665A进行硫酸净化。36
在分析之前将沉淀物样品过筛至1mm,用Na 2 SO 4干燥,并用丙酮:己烷(1:1v / v)进行索氏提取2小时。27提取物通过颗粒状Na 2 SO 4,然后用Mäenpää等人的浓硫酸清洗。37种从与沉淀物泵获得的生物样品提取物(均质化使用超声处理)进行清洗之后的相同的协议。
使用GC-MS(Hewlett-Packard系列6890气相色谱系统与Hewlett-Packard 5973质量选择检测器偶联),用Figueiredo等人描述的方法测量所有样品的PCB含量(21种目标同源物)。27和Abel等人。6有关所用PCB方法的更多详细信息,请参见SI。
所有结果表示为平均值±标准偏差。使用SigmaPlot 13.0(Systat软件)进行统计学分析。使用单因素方差分析和Dunnett's posthoc检验(α= 0.05)测试数据之间的显着差异。当不满足相等方差(Brown-Forsythe检验)或正态性(Shapiro-Wilk检验)的假设时,使用非参数Kruskal-Wallis检验,然后使用Dunn's posthoc检验。
实验室试验中C. riparius幼虫的生长不良使得有必要将一些处理组中的多个微生物的生物合并用于PCB分析。这在所施加的顶部沉积物层的两个最低剂量(分别为1.3和2.6kg / m 2 [0-1和1-2mm])中将重复次数减少到n = 1和n = 2 ,从而减少了发现统计意义的可靠性。这不影响来自不利影响生物测定或L. variegatus实验的数据。
在现场试验期间获得的数据的范围和质量(样品重复的可用量)不允许进行彻底的统计分析。将来自监测的测试位点的数据合并到治疗组(标记位点PL-1和PL2)和对照组(参考位点Ref-1至4)。使用独立t检验比较两组。
从测试图中取得的沉积物岩心的目视检查显示,在修正后1天,形成了均匀的AC层并盖住了沉积物。层厚度在芯之间变化(平均几厘米厚),没有芯显示AC帽中的间隙(图S2A)。两个月后采取的沉积物核心显示AC厚度显着降低(图S2B)。虽然盖的部分可能已经通过生物扰动工作到底层泥沙,4对损失的主要因素可能是一个或多个风暴事件。然而,在大多数岩心中仍然可以看到AC层,并且地块上的沉积物BC值显着升高(图S1和表S2))。影响湖底的强风的另一个影响是在AC层顶部沉积了大量沉积物(图S2B)。通过支流Tervajoki河输入的沉积物可以进一步放大这一点。盖帽中AC的损失和沉积物的沉积继续以高速率进行。在修正后10个月采集的沉积物核心中仅可见非常薄的独特AC层,其中一些核心显示没有可见的AC痕迹。沉积物BC含量证实了这些目测观察结果,PL-1值在10和14个月后降低(图S1)。尽管在PL-2处获得的样品保持略高的BC水平,但它们并不显着高于所有参考位点。这可能是由于风暴事件导致的AC快速损失和沉积物沉积的稀释效应造成的。与AC层相比,新沉积的沉积物的量高(> 20mm,图S2C)。用沉积物捕集器测量的平均沉降速率为34.2±1.5g干物质/ m 2 /天。这种程度的累积速率表明,由于风引起的水湍流,大部分沉积的材料从相邻的未处理地点重新定位。38交流修正后沉积物沉积物的分析显示TOC较高的物质(52.5-63.5 g / kg,表S2))和较低的dw含量(19.7-17.5%)。沉积在剩余AC层顶部的高度有机沉积物显示出相对高的PCB浓度(表S2和图S2),这是由于对HOC具有高亲和力的较轻有机颗粒的选择性转运。39对于许多沉积物易受风致湍流影响的水体来说,这是一个问题。一个可能的解决方案是用AC处理湖面较大的区域,确保未经处理的污染沉积物不会沉淀在其他地方。
在风暴期间从场地快速损失吸附剂颗粒和高沉降速率的稀释效应的组合导致低AC浓度(BC值)。然而,必须指出的是,在非常低的AC浓度下可以观察到修复潜力和不利影响。6虽然在六个现场测量的BC含量表明AC水平低于预期值,但这并不一定排除施加的吸附剂的任何影响。
六个监测点(地图S1和表S2)中PCB和TOC水平的强烈空间变化不是静态的。回顾先前对湖中发现的PCB水平的研究表明,浓度会随着时间的推移而发生强烈变化。已在刚刚湖的南端被测量报告污染物水平(接近支流Tervajoki河;相同的面积,本研究)分别达到10.7,26 4.5,37 3.4,40和0.798毫克/千克。41这些数据将进一步支持Kernaalanjärvi湖中的沉积物经常被重新定位(动态沉积系统)的理论,从而产生更高和更低PCB水平的变化斑块。来自六个采样点和沉积物捕集器的沉积物中PCB同系物剖面相对均匀(图S2)。主要成分是三 - ,四 - ,五 - 和六 - CB。
吸附剂颗粒在试验区上的保留不良以及污染沉积物的快速覆盖导致了以下假设:预期AC薄层盖没有很大的修复成功。这是通过在现场采集的底栖无脊椎动物上PCB生物累积所获得的数据证实(图如图一1 ;具体同系物的数据在显示表S3)。在AC修正后两个月采样的生物显示与未处理的参考位点相比较低的PCB生物累积,表明初始修复成功。然而,在10个月和14个月之后,在AC修正的地块中没有发现PCB吸收的统计学显着降低,这表明高沉降率已经损害了所施加的AC帽的修复效率。由于修正图(BC测量)中实际保留的AC浓度的不确定性,现场数据的确定性相对较低,只能与实验室后续试验一起进行评估。
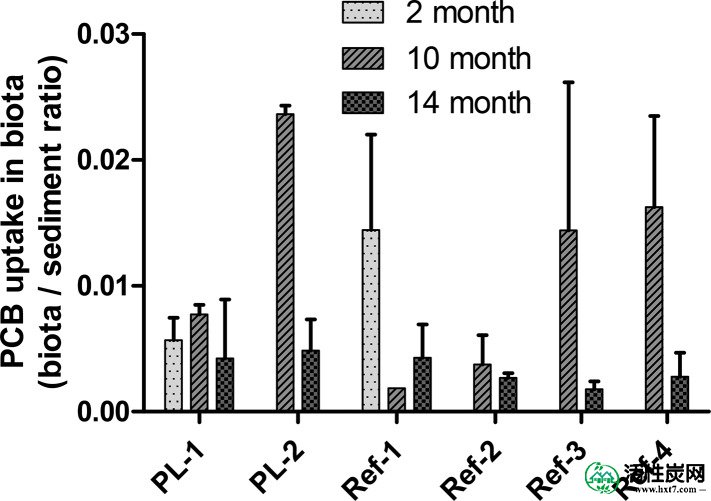
PCBs的平均生物积累,以生物群中PCB浓度与TOC标准化沉积物浓度的比值给出,在田间采集的底栖生物中,在施加AC薄层帽后的第2个月,第10个月和第14个月测量。对于两个月的采样点,数据仅适用于站点PL-1和Ref-1。采样的生物主要是摇蚊和Oligochaetes(更详细的,分类群特定的生物累积数据见图S3)。
在现场试验中观察到的低修复成功的假设是由新沉降的,受污染的沉积物颗粒引起的,这一假设通常可以通过实验室实验来确认。如现场所见,由于覆盖AC层的大量污染沉积物,修复效率降低。与C. riparius,顶部沉积层厚度对PCB摄取生物体的影响是明显的(图Figure22一个)。当覆盖AC层的沉积物少于1毫米时,测试生物中的PCB体负荷减少了大约1毫米。与没有AC的未修正对照组中的个体相比,81%。虽然不能直接比较,但由于不同的AC施用方法,这与在沉积物中混合的高剂量AC(2.5%沉积物dw)所报道的范围相当。42然而,当覆盖沉积物的量增加时,PCB体负荷相应增加,并且在AC上方沉积物为5-7 mm(5.3 kg / m 2或2-5 mm),不再具有统计学意义AC对PCB吸收的影响。
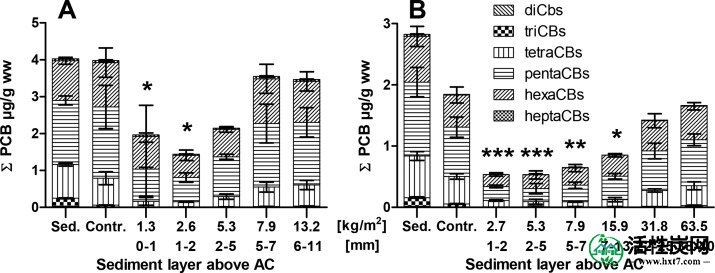
摇头虫(A)和Lumbriculus variegatus(B)的PCB生物积累(实验室测试)暴露于沉积物中,用活性炭薄层盖修正,其中已被越来越多的污染沉积物覆盖。沉积物PCB浓度显示为μg/ g dw用于比较(不包括在统计分析中)。显着性水平:*** p <0.001,** p <0.01,* p <0.05。
为L.粘多糖,交流补救效率的降低发生在显著更高量的沉积物覆盖吸附剂层(图Figure22 B)。在顶部沉积物层剂量高达5.3 kg / m 2或2-5 mm时,观察到PCB生物累积量大幅降低64%-70%。这些值与先前公布的用于交替施加薄层盖的沉积物中的L. variegatus的结果非常一致,并且没有进一步的沉积物覆盖。4,6因此,假设顶部沉积物层在这些剂量中几乎没有效果。观察到在PCB摄取略有增加,当沉积物覆盖厚度增加至7-13毫米(7.9千克/米2),虽然在PCB bodyburdens一个54%的减少; 与未修正的对照相比,这仍然意味着显着降低。只有至少22-25 mm(31.8 kg / m 2)的沉积物覆盖AC层,PCB生物累积不再有统计学上显着的降低。将其与对C. riparius具有相同效果的2-5 mm(5.3 kg / m 2)进行比较,表明两种测试生物之间存在明显差异。这可能是由于更明显的沉积物居住活动L.粘多糖,这是众所周知的埋到相对深的沉积层(例如,下至由Abel等观察45毫米。6实验室条件下)。另一方面,摇蚊主要栖息在沉积物表面。43
这些结果与现场观察到的趋势相当。在前两个月内沉积的沉积层仍然相对较低(5-10毫米; 图S2)。这与在实验室后续试验期间显示两种生物体的PCB生物累积性降低的最大顶部沉积物层厚度相当。在某种程度上,这证实了在AC修正案后的头两个月内在现场看到的初步补救成功。然而,10个月后,在地块上沉积了> 20毫米的沉积层。这超过了仍然能够在实验室中使用任一测试生物进行可测量的修复成功的量。此外,在10个月和14个月时样品中较高比例的摇蚊(由于使用沉积物泵样品)可能会对掩盖修复效率产生影响:虽然不显着,但与Oligochaetes相比,修复效率更高。在现场试验中也指出了摇蚊(图S3)。
两种测试生物的停留深度为AC对PCB生物累积的不同影响提供了合理的解释。L. variegatus的更深的居住活动意味着它们暴露于更接近AC层的沉积物颗粒,即使沉积更大量的沉积物。对于C. riparius由于其栖息地更加局限于沉积物表面,因此AC薄层盖的主要影响是与下面的污染沉积物的物理分离。另外,吸附剂层防止污染物扩散到新沉降的沉积物和水柱中。然而,如果在吸附剂施用后沉积的材料被污染,则由AC帽产生的屏障不再足以减少生物体对PCB的吸收。在这种情况下,修复成功主要依赖于污染物从沉积的沉积物到下面的吸附剂颗粒的被动扩散。44吸附剂和沉积物颗粒之间的距离增加会减缓这一过程,导致随着实验中顶部沉积物层厚度的增加,PCB吸收量增加。这可能在修复方案中成为问题,其中沉降速率很高或者可能发生大量颗粒的突然沉积,如Kernaalanjärvi湖中的情况。然后,相对于新沉降的沉积物的输入速率,扩散可能变得太慢,从而足以使吸附到AC。
在10和14个月采样,丰度,生物量和所采样的无脊椎动物的多样性是在所有六个研究位点(低图Figure33)。在两个月时,生物量和生物体丰度较高,表明湖泊底栖动物的状况每年都有强烈的波动。在早期(2006-2015)作为Figueiredo等人的一部分进行的底栖动物调查中也观察到了这种可变性。27研究和芬兰环境管理局的在线环境信息系统数据库(Hertta)(表S4)。
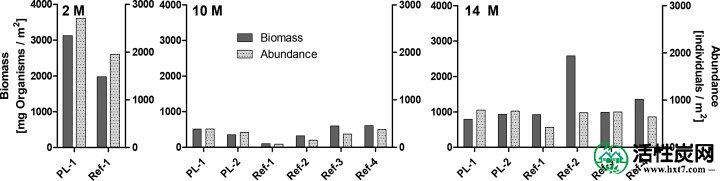
在现场施用活性炭薄层盖后2,10和14个月,丰度和生物量(所有分类群合并)。对处理图(PL-1,PL-2)内的两个位点进行取样,并与四个周围参考位点(Ref-1至Ref-4)进行比较。只有PL-1和Ref-1的数据可用于第一次采样。不同类群的个体丰度和生物量数据列于表S4-S7中。
在整个监测时间段内采样的绝大多数无脊椎动物可归类为摇蚊科或Oligochaeta(表S5-S8)。这些分类群发生在所有抽样的地点,而其他分类群只是零星地发现。2个月和14个月后,分类丰富度(多样性)略高于(4-5)10个月(2-3)。生物体的总体低多样性,生物量和丰度使得很难得出明确的结论。但是,所有六个站点之间的差异似乎高于用AC和四个参考区域修改的两个站点之间的差异。从获得的数据中无法看出AC处理的不利影响,例如其他田间研究中报告的底栖物种丰度,生物量和多样性的减少。7,21,22这可以归因于AC的初始损失,从而保持低剂量,以及粘土添加到吸附剂层的电位缓解效应。6无统计学差异显著观察在任何监视时间(总生物质或情节和参考点之间的生物体的数目图Figure33),表明的AC修正过在Kernaalanjärvi湖监视时段没有不利影响。在AC施用后两个月进行的取样显示在地块处的底栖生物的丰度和生物量较高,但该采样点的数据不够广泛,无法进行稳健的统计分析。Kupryanchik等。15,25表明在AC应用后六个月或更长时间后,底栖群落可以恢复。由于本研究中的第一次广泛采样是在施加吸附剂盖帽后10个月进行的,因此可能已经进行了这种恢复。另一种解释可能是上述AC帽稳定性的问题以及来自相邻位置的未处理沉积物的覆盖。Cornelissen等。7在特隆赫姆海港通道中施加由AC粘土混合物组成的薄层盖,深度为4-6米,并报告在12个月后最初施加的AC损失约40%。Kernaalanjärvi湖现场的深度相当浅,因此位置更加暴露,可以解释AC的更高损失。与新沉积物下剩余吸附剂的埋藏相结合,这些损失可能降低了对环境的总体影响。
既L.粘多糖和C. riparius能够存活并增加其生物量在曝光期间在未修改的控制沉积物和表现出较强的不利影响的交流薄层帽。这些效果高量级为两种生物体的当吸附剂层上覆盖着只有最少量的沉积物(的图Figure44)。虽然C. riparius显示出比对照中观察到的显着更低的最终生物量(生长),但是L. variegatus甚至显示出生物量的损失。这与先前的出版物一致,其显示AC对这两种测试生物的显着不利影响。6,40,45然而,一旦沉积物覆盖AC层的量增加时,在生长和发育不良影响 C. riparius迅速下降。随着2-5毫米(5.3千克/米的层 2)上的AC的顶部沉积物,存在于生长速率未经修正的控制沉积物(ANOVA,Dunnett的事后)无统计学差异显著。幼虫的存活率遵循与生物量相同的趋势。虽然在对照中几乎没有观察到死亡率,但只有22%和32%的所有幼虫存活,其中两个最低的顶部沉积层。在覆盖AC的5.3kg/ m 2(2-5mm)沉积物中,这增加到77.5%。两种最高剂量分别为7.9和13.2 kg / m 2 (5-7和6-11 mm)显示出良好的存活率为86%和89%,不再显着低于对照组。
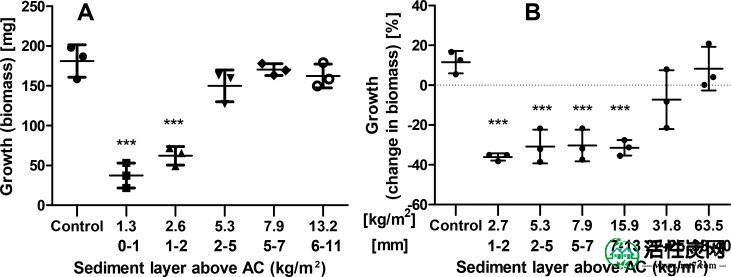
实验室测试期间摇蚊(A)和Lumbriculus variegatus(B)的生长,其中AC薄层盖已经被越来越多的受PCB污染的沉积物所覆盖。选择未修饰的沉积物作为对照组。(水平线:平均值;胡须:标准差; ***:显着性,p <0.001)
相比之下,即使当AC帽上方的沉积物层增加7-13mm(15.9kg / m 2)时,L。variegatus也表现出相对强烈的不利影响(生物量损失)。只有具有沉积物的大于20毫米(31.8千克/米2覆盖吸附剂层)没有不利影响开始下降,并且控制水平在约达到 40毫米(63.5公斤/米2的顶部沉积层)。
AC的不良反应似乎与其修复潜力密切相关。增加的生长的图案严格按照对于每个使用的测试物种的(在PCB摄取的增加图Figures22和AND4)。4)。这一发现表明,沉积物的覆盖率首先降低了吸附剂对测试生物体的总体影响,无论是对不利影响还是有益影响。随后,导致PCB吸收减少的L. variegatus更深的居住活动也导致吸附剂颗粒的暴露增加,这反过来导致观察到的不利影响。反之亦然,与C. riparius的AC颗粒更加严格的空间隔离 以增加PCB吸收为代价保护它们免受不利影响。
这种相互依赖性有助于解释在实验室和现场试验中观察不良反应的鲜明对比。由于高沉降速率,AC在田间的总体较低影响不仅会导致较低的修复效率,而且还会导致AC本身的较轻的不利影响。在田间使用的SediMite颗粒中粘土的存在可以进一步降低不利影响。6,7的在实验室中观察到的不良影响的程度因此可以夸大。
不利和有益效果相关的另一个可能原因是它们之间的潜在依赖性。降低的PCB生物累积可至少部分地是由活性炭引起的不利影响的结果,而不是由于污染物与AC颗粒结合而导致的PCB生物利用度的降低。5,46降低进料速率6,14,16或抑制营养同化效率20已被提议作为AC的不利影响的潜在原因,例如减少的生长。然而,降低的沉积物摄取速率(摄食)将主要影响测试生物体从活性PCB摄取途径的暴露。另一方面,被动(真皮)摄取途径不受沉积物摄取的影响。47然而,两个参数之间的部分依赖性可能导致高估AC的修复效率。这种过高估计的程度受到主动摄取途径的相对重要性的影响,其随着污染物疏水性的增加而增加。48,49对于LakeKernaalanjärvi沉积物而言,较低氯化且疏水性较低的PCB同系物构成了PCB污染的主要部分,因此假定修复效率对不利影响水平的依赖性相对较低。图Figure22和图S3表明未经修正的对照沉积物中的生物占据沉积物中的大多数同系物群,具有相似的同化效率。在施加AC和低沉积物沉积的情况下,发生转变,并且沉积物中具有最高氯化程度的同系物(hexa和hepta-CBs)的吸收增加。随着AC层上方沉积层厚度的增加,趋势相反。这表明活性摄取途径所支持的同源物以更高的速率累积,即使在这些治疗组中可能降低摄食。然而,这也可能是由于更快的隔离,AC对较低氯化同系物的相对较高的吸附效率。1,50,51
Cornelissen等人的实地研究。8表明,在无法避免输入受污染沉积物的地方,通常可以进行基于交流的沉积物修复。这可以通过本研究中的实验室试验结果得到证实。然而,两种测试生物的比较表明,在这些环境中,更深层居住的底栖生物的存在对于使修复工作取得长期成功至关重要。只有当足够量的吸附剂颗粒通过生物扰动不断向上运输到新沉降的沉积层中时,才能确保长期的修复成功。在这些条件下,使用清洁材料手动覆盖施加的AC层将是不明智的,因为在任何情况下都应避免生物活性沉积层与吸附剂颗粒的物理分离。这种含义的重要性可以通过LakeKernaalanjärvi修复工程的可衡量成功率很低来证明。除了整体低生物活性外,底栖动物群的组成(以浅居住的摇蚊科为主)使得AC薄层的应用不适合这个动态的浅水北方湖泊现场的现状。
在这项研究中获得的结果表明,由浅层住宅生物占主导地位的场地理论上可以在AC薄层盖引起的初始扰动后更快地恢复。在污染源可以可靠地关闭的情况下,这将是非常有益的,导致仅覆盖吸附剂层的清洁沉积物。AC盖将保持相对不受干扰的层,将旧的,污染的和较新的清洁沉积物分开,从而防止污染物流入生物活性沉积层。通过将盖子混合到下面的沉积物中,大量更深的居住生物仍然可以有利于加速污染物的隔离。52此外,该过程有助于稳定层,防止水湍流从现场漂移。否则,必须通过用另外一层干净的沙子或沉积物7手动覆盖薄层盖子或者将吸附剂主动混合到沉积物中来实现这种稳定化。53然而,当一个地点预计会进行更深层的生物扰动时,可能需要施加更大量的AC,因为当混合到沉积物中时,少量的AC可能会被过快地稀释。