发布日期:2018-11-07 11:46 来源:活性炭网 作者:活性炭网 浏览数:
图形概要 关键词: 颗粒活性炭,种间电子转移,甲烷生成,相互作用氧化,挥发性脂肪酸 去: 抽象 颗粒活性炭(GAC)可以促进有机废物产生甲烷,但是已经报道了各种各样的剂量。
通过厌氧消化生产生物甲烷是全球利用生物能源最成功的策略之一(Ferguson等,2016,Xiao等,2013)。通常,厌氧产甲烷作用是由参与水解,产酸,产乙酸和产甲烷过程的几组微生物进行的。发酵细菌和产乙酸菌从复合大分子的降解产生挥发性脂肪酸(VFA)和其他中间体,例如乳酸,乙醇和丁醇等(Karthikeyan和Visvanathan,2013,Lee等,2016)。产甲烷菌利用简单的有机底物,例如乙酸盐,CO 2 / H 2甲醇和甲酸生成甲烷(Mcinerney等,1981,Pan等,2016,Stuckey和David,1999)。
由于乙酸盐以外的VFA不能直接用于产甲烷菌,因此丙酸和丁酸主要存在于高负荷蒸煮器的流出物中(Li等,2017,Viggi等,2014)。事实上,丙酸盐和丁酸盐的氧化在标准条件下是高度的,并且只有当产甲烷菌保持这些中间产物的浓度较低时才会发生(Müller等人,2010)。丙酸盐和丁酸盐首先被产乙酸菌转化为乙酸盐和CO 2 / H 2,然后它们被乙酸 - 和氢 - 营养 - 产甲烷菌利用。为了使反应在能量上有利,离子间的H 2转移是必不可少的(Müller等,2010,Schink,1997)。
有大量研究旨在通过补充导电铁氧化物(例如磁铁矿和Fe 0(De Vrieze等,2016,Yamada等,2015))或导电碳材料(如活性炭)来加强产甲烷条件下的间隙代谢。(Liu等,2012,Xu等,2015),生物炭(罗等,2015),碳布和石墨(Dang等,2017,Lee等,2016,Mumme等, 2014年,赵等人,2015年在具有导电材料的反应堆中产生的受控甲烷产生可能归因于促进直接种间电子转移(DIET)(Li等,2017,Liu等,2012,Rotaru等,2014a,Rotaru等)。 al。,2014b)。一个潜在的原因是非生物传导材料的可用性可以节省细胞能量,因为它们不需要产生广泛的细胞外生物电连接,例如导电菌毛和c型细胞色素(Zhao等,2015))。
碳材料还可以为有效固定互补微生物提供高比表面积(Li等人,2017,Luo等人,2015,Kindzierski等人,1992)。赵等人。(2016)发现的丰度地杆菌物种,如G.硫还原和G. lovleyi在丙酸-丁酸和喂养反应器提高,占附接到生物炭社会的20%,同时Syntrophomonas和Smithella物种下降。然而,Dang等人。(2017)据报道,粒状活性炭(GAC)似乎显着增加了诸如Syntrophomonas ,Symbiobacterium和Desulfotomaculum物种之类的互补细菌的丰度,而Geobacter在任何补充GAC的OFMSW反应器中都没有富集。不同的结果可能归因于不同的接种物或不同的碳源,例如单/混合VFA,乙醇或复杂的有机物质(Kato等,2012,Wang等,2016)。因此,需要进一步研究以了解用碳材料在蒸煮器中的丙酸盐和丁酸盐的互变群落。
此外,注意到在大多数研究中仅报道了AC处理组和空白组之间的简单比较,并且AC的补充剂量变化很大(例如0.005至50g / L),如表S1所示。尽管如此,陈等人。(2014)报道,当碳布量从10 g / L加倍到20 g / L时,产甲烷反应器中乙醇的代谢率增加,但没有进一步的解释。因此,有必要澄清是否存在剂量依赖效应,并为相关实践提供定量依据。
基于上述基本原理,本研究分别在添加一系列GAC剂量(即0.5-25g / L)的产甲烷消化器中研究了乙酸盐,丙酸盐和丁酸盐的降解动力学。同时,比较了两种不同的有机载荷,即1g / L和5g / L. 通过使用一级动力学和改进的Gompertz模型评估VFA的降解和甲烷产生的速率。高通量技术用于16s rDNA测序以检测微生物群落结构,并且本研究讨论了由于GAC添加导致的降解细菌和产甲烷菌的互变性VFA的交替。
取自曲阳污水处理厂(中国上海)的接种污泥在实验室规模的厌氧消化池中预培养。然后将污泥转移到分别加入不同VFA(即乙酸盐,丙酸盐和丁酸盐)的三个反应器中,以富集特定的脂肪酸降解菌。在连续几批培养后,每种VFA物种1g / L在5-7天后几乎可以降解。培养温度保持在35±2℃。
在实验期间,将确定体积的富集污泥置于具有400mL消化液的500mL血清瓶中,以使总挥发性悬浮固体(TVSS)的最终浓度为1g / L. 将不同剂量的GAC补充到血清瓶中,即分别为0,0.5,5和25g / L,记录为GAC0,GAC0.5,GAC5和GAC25。GAC购自Sinopharm Chemical Reagent CO.LTd。通过shive获得20-40目GAC,其表观密度和比表面积为430±30g / L和875-1185m 2。/ g,分别。然后,在批次研究中以1g / L和5g / L的浓度评估乙酸盐,丙酸盐和丁酸盐与特定富集培养物的甲烷转化率。在两批预培养后收集数据,每个测试一式三份进行。用培养箱摇床(DKY-II,Shanghai Duke Auto Co.,China)将反应器的温度保持在35±2℃。
基质配方:特定碳源(例如乙酸盐,丙酸盐和丁酸盐),相应的NH 4 Cl和KH 2 PO 4质量根据C:N:P = 100:5:1加入反应器中。另外,加入2mL / L的痕量元素溶液(El-Mamouni等,1995),用HCl和NaOH溶液将pH调节至7.2。最后,所有反应器在启动前用氮气冲洗超过10分钟。
通过配备有气体流量计的AMPTS II(Bioprocess,Sweden)自动测量甲烷产生量。对每个反应器的液体进行取样和分析,以监测总有机碳(TOC)和VFA的变化。在用0.45μm滤膜过滤后,通过配备有折射率检测器的高效液相色谱(Waters 2695/2489,USA)分析VFA的浓度。通过总碳/总氮分析仪(Multi N / C 3100,Jena Co.,Germany)分析TOC。
在实验结束时从GAC0和GAC5反应器收集污泥样品。使用Power Soil TM DNA分离试剂盒(Mo-Bio Laboratories Inc.,CA)提取所有样品的总DNA 。“HAc0”,“HPr0”,“HBu0”的标签代表从GAC0取得的污泥样品和各自的底物,“HAc1”,“HPr1”,“HBu1”代表取自GAC5的样品。通过在Illumina平台(Illumina Miseq PE300)上使用高通量焦磷酸测序来分析样品的微生物群落。使用细菌引物515F(50-GTG CCA GCM GCC GCG GTA A-30)和806R(50-GGA CTA CHVGGG TWT CTA AT-30)构建扩增子文库用于焦磷酸测序,用于微生物16SrRNA基因的V4-V5区域(Xu)等,2015)。测序数据已存入公共数据库NCBI,登录号为SRP134710(https://www.ncbi.nlm.nih.gov/sra/SRP134710)。
将改良的Gompertz模型(方程(1))拟合到实验观察到的累积CH 4产生曲线(Lü等人,2013)。VFA的变化符合一级动力学(方程(2))。
在哪里,在Eq。(1),M(t)的,P,R,λ是累积产量(毫摩尔-C /毫摩尔-C 加入)在时间t,最终甲烷产率(毫摩尔-C /毫摩尔-C 加入)在温育结束时,CH 4和CO 2产生的最大生产率(mmol-C / mmol-C 加 / d)和滞后期(d); e是2.71828。在Eq。(2),C 0和C(t)是特定底物的初始浓度和时间t的浓度; k是一阶退化常数。
对于克服发酵中间体(尤其是丙酸盐和丁酸盐)的厌氧氧化中的热力学障碍,中间相互作用是必不可少的(Hattori,2008)。在本研究中,我们分别检测了HAc,HPr和HBu的产甲烷降解,分别在不同有机负荷(即1 g / L和5 g / L)下添加GAC,其中累积甲烷产生和VFA下降的概况如下:图 1和AND22。
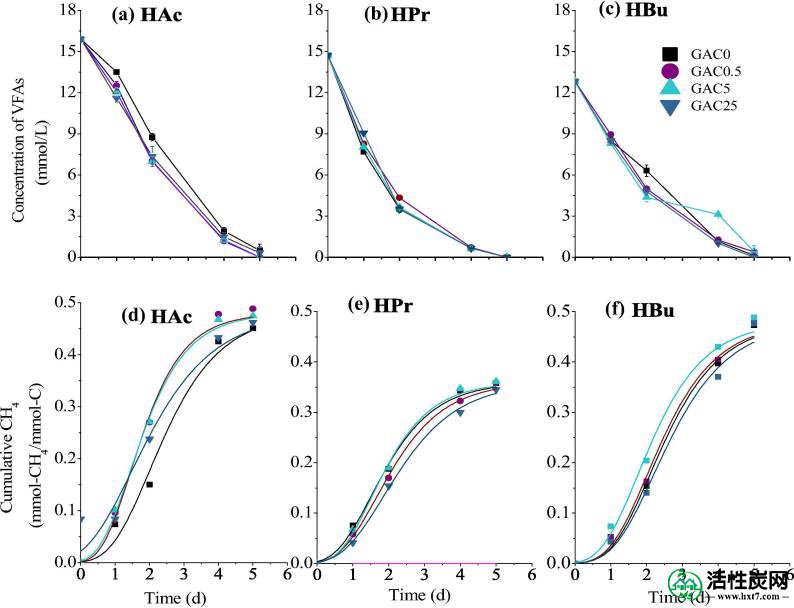
1 g / L VFA(a-c)的降解曲线和相应的甲烷产量(e-h)与不同剂量的GAC。
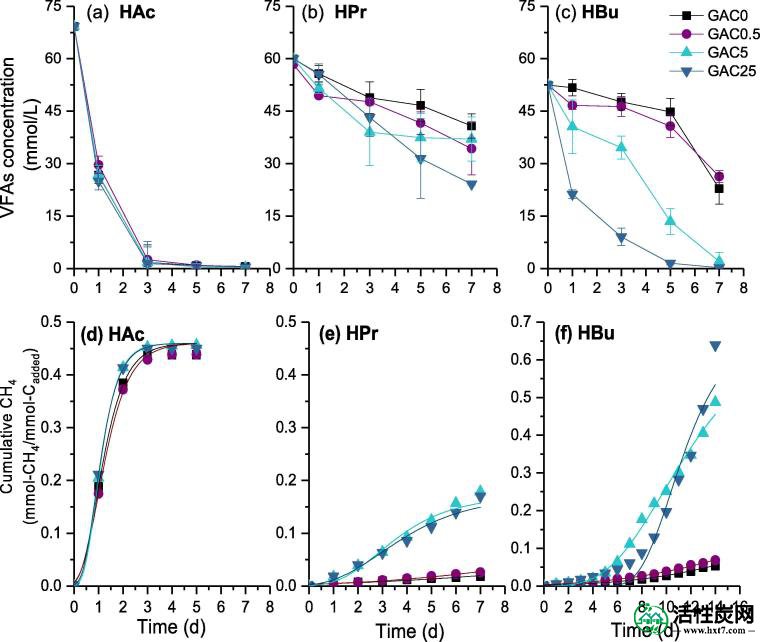
使用不同剂量的GAC,5g / L VFA(a-c)和相应的甲烷产生(eh)的降解曲线。
初始浓度为1 g / L时,三种VFA即HAc,HPr和HBu迅速降解,5天后几乎消失。同样,甲烷产生的滞后阶段可以忽略不计。这表明富集的微生物聚生体对特定底物(即乙酸盐,丙酸盐和丁酸盐)具有强代谢能力。此外,具有相同底物和不同GAC剂量的反应器之间没有明显差异,如图1所示。计算得到的改进Gompertz模型的最终甲烷产率(P CH4),最大产率(R max)和滞后期(λ)的动力学值如图3所示。在P CH4从乙酸乙酯为0.45-0.49毫摩尔-CH 4 /毫摩尔-C 加入,这是接近0.5毫摩尔-CH理论值4 /毫摩尔-C 加入。HAc 的平均R max为0.16mmol-CH 4 / mmol-C 加 / d,该值略高于先前的研究,即0.107-0.143mmol-CH 4 / mmol-C 加入 / d(Lü等人。 ,2013)。同时P CH4从丙酸和丁酸比其理论值稍低,即0.48和0.68毫摩尔-CH 4 /毫摩尔-C 加入。因此,GAC在低强度下的强化效果不明显。
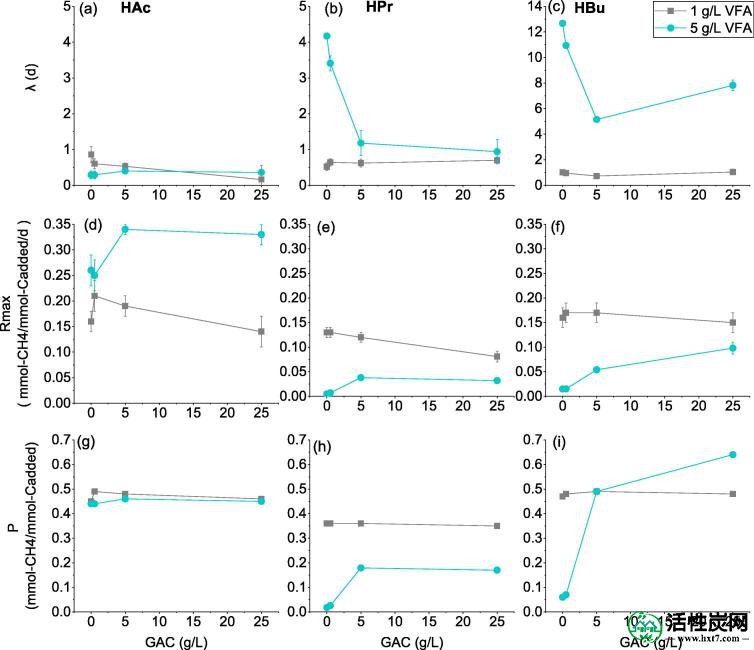
计算的改进的Gompertz模型的滞后期λ(a-c),最大生产率R max(d-f)和最终甲烷产率P CH4,(g-i)的动力学值。
初始浓度为5 g / L时,醋酸盐驯化培养物仍然表现出较高的代谢活性,GAC的补充几乎不影响甲烷产生率。最终得到甲烷P CH 4由醋酸约为0.45毫摩尔-CH 4 /毫摩尔-C 加入,这是接近在乙酸(例如,1克/升)的低强度而得到的值。
然而,当底物浓度从1g / L增加到5g / L时,丙酸盐和丁酸盐的产甲烷转化率明显受到抑制。丙酸盐和丁酸盐反应器的滞后期时间为4.2天,GAC0为12.7天。这与先前的研究一样,产甲烷易受高浓度VFAs的影响,主要归因于未解离的VFA抑制产甲烷菌的生长和代谢(Pavlostathis和Giraldo-Gomez,1991)。然而,在本研究中添加GAC被发现可显着加速丙酸盐和丁酸盐的代谢。如图2所示当将GAC浓度从0.5g / L增加到25g / L时,丙酸盐反应器的滞后期从3.4d减少到0.9d,而丁酸盐反应器的滞后期从12.7d减少到7.8d。
计算每种VFA物质的降解动力学(k)并列于表1中。基本上,R 2高,只有HBu 的R 2(5.0 g / L)低于其他,特别是在低GAC剂量时。原因可能是由于抑制作用,导致与S形函数的偏差。使用5g / L的丙酸盐作为底物,对于消化器中的k值,发现约1.5倍的增量,即当将GAC剂量从0增加至25g / L时,从0.0022至0.0056h -1。对丁酸盐降解的刺激作用更显着,其动力学值增加了7.1倍,即从0.0043增加到0.0306 h -1当GAC剂量从0增加到25 g / L. 上述结果清楚地表明,GAC的补充可以剂量依赖性地加速丙酸盐和丁酸盐的甲烷生成。李等人。(2015)也报道了纳米Fe 3 O 4的刺激作用可能受到补充浓度的限制。还应注意的是,尽管通过补充GAC显着提高了丙酸盐和丁酸盐的降解速率,但它们的速率仍然低于醋酸盐的0.0386-0.0431h -1范围。这些结果进一步证实了丙酸盐和丁酸盐的转化难度以及进一步探索促进机制的重要性。
丙酸盐和丁酸盐消耗速率的一级动力学。
| GAC剂量 |
醋酸
|
HPr的
|
HBU
|
||||
|---|---|---|---|---|---|---|---|
| VFA | k(h -1) | R 2 | k(h -1) | R 2 | k(h -1) | R 2 | |
| 0克/升 | 0.0386±0.0065 | 0.92 | 0.0022±0.0002 | 0.97 | 0.0043±0.0015 | 0.83 | |
| 5 | 0.5克/升 | 0.0371±0.0049 | 0.95 | 0.0033±0.0004 | 0.92 | 0.0036±0.0009 | 0.77 |
| 克/升 | 5克/升 | 0.0431±0.0046 | 0.97 | 0.0029±0.0041 | 0.75 | 0.0180±0.0041 | 0.82 |
| 25克/升 | 0.0393±0.0078 | 0.90 | 0.0056±0.0004 | 0.99 | 0.0306±0.0021 | 0.98 | |
| 0克/升 | 0.0228±0.0042 | 0.91 | 0.0328±0.0013 | 0.99 | 0.0251±0.0040 | 0.99 | |
| 1.0 | 0.5克/升 | 0.0279±0.0044 | 0.93 | 0.0319±0.0025 | 0.98 | 0.0247±0.0022 | 0.98 |
| 克/升 | 5克/升 | 0.0274±0.0041 | 0.94 | 0.0329±0.0017 | 0.99 | 0.0248±0.0031 | 0.99 |
| 25克/升 | 0.0252±0.0036 | 0.94 | 0.0333±0.0023 | 0.99 | 0.0268±0.0025 | 0.99 | |
底物和中间产物的动力学如图4所示。在具有不同底物和GAC剂量的消化器中发现不同的中间产物即乙酸盐的积累。Scholten和Conrad(2000)也发现在用丙酸盐或丁酸盐作为唯一底物的反应器中积累乙酸盐。对于克服脂肪酸的厌氧氧化中的热力学障碍,互变相互作用是必不可少的。涉及乙酸盐,丙酸盐和丁酸盐的共同降解的主要途径如下所示
方程的吉布斯自由能。(3),(4),(5)相当高,仅在H 2的低分压或低浓度的乙酸盐时变为exergonic反应(Müller等,2010)。因此,同生降解需要氢营养和乙酸产甲烷菌消耗H 2和乙酸盐。

在不同GAC剂量下HPr(a-d)和HBu(e-h)的厌氧降解过程中产乙酸中间体的变化。
在以丙酸盐为底物的消化器中,观察到丙酸盐的缓慢下降速率,并且几乎检测不到中间产物乙酸盐的积累。然而,发现乙酸盐在丁酸盐作为底物的沼气池中积累(图 4e-h)。由于接种物是富营养的产乙酸细菌和产甲烷作用的富集培养物混合物,检测到的乙酸盐浓度是同生型乙酸发生和产甲烷作用之间的平衡结果。通过观察乙酸盐积累状况,结果表明,丙酸盐和丁酸盐消化器中产甲烷作用略有下降,同时补充GAC可引发丙酸盐和丁酸盐的产乙酸转化。Viggi等人的研究。(2014)评估了导电磁铁矿颗粒在蒸煮器中发生的最大电子载流量,即DIET,其速率比种间H 2转移的速率高10 6。这种情况可以应用于目前的降解丁酸盐和丙酸盐的研究,但随着GAC的电导率小于磁铁矿颗粒,电子载流子通量的速率较慢。
此外,应注意丁酸盐的底物在8天内倾向于在GAC25中耗尽(图 4h),而甲烷的生成持续14天(图2f )。一方面,除了乙酸盐之外,其他中间产物如甲酸盐和H 2可能存在于蒸煮器中以促进甲烷的产生。如图S1所示当丁酸盐在第7天几乎消耗时,剩余的TOC浓度约为211mg / L.然而,在该研究中尚未监测氢浓度,这需要进一步研究。另一方面,剩余的甲烷产生可能来自高剂量GAC吸收的底物。吸附实验结果表明,GAC对HAc,HPr和HBu的吸附容量分别为22,25和38 mg / g。
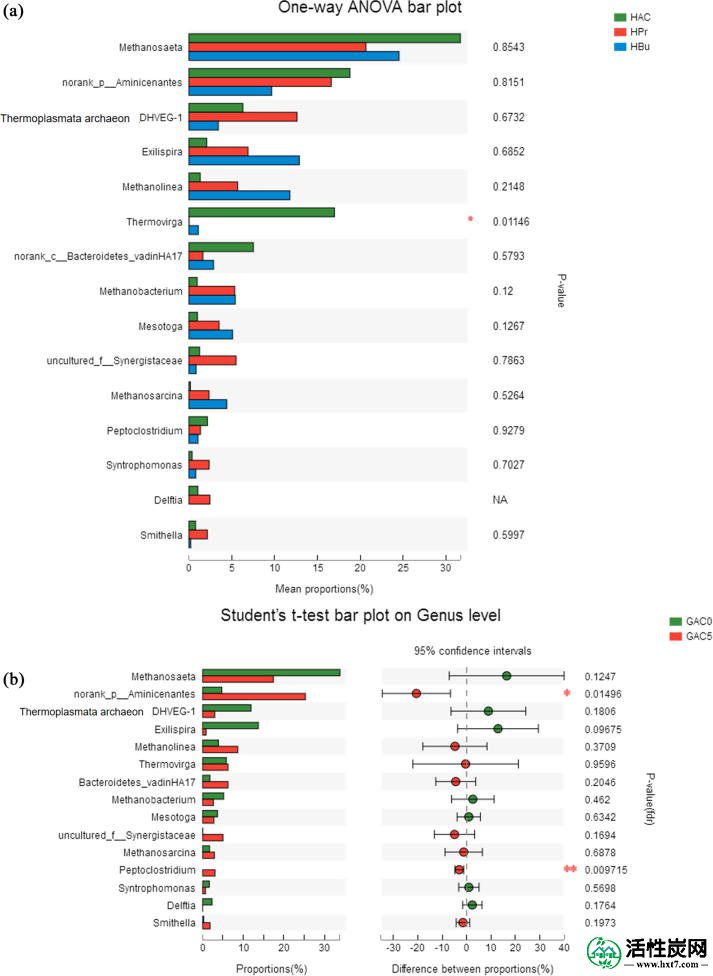
该研究比较了富含不同底物的微生物群体,即乙酸盐,丙酸盐和丁酸盐,以及通过比较GAC0和GAC5补充GAC的效果。细菌和古菌群落在属水平上的相对丰度显示在图5和表S3中。
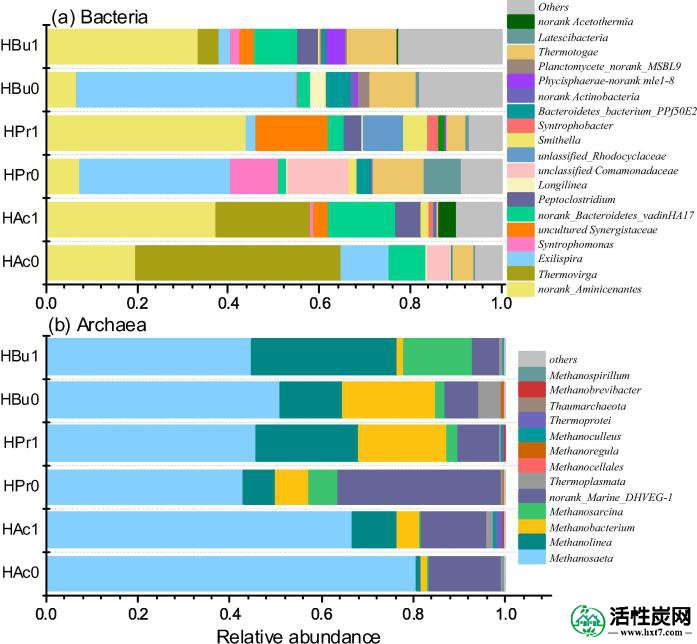
细菌(a)和古菌(b)在厌氧污泥中具有5g / L GAC和不含GAC的属的水平。
细菌群落结构随着不同的孵化条件而变化。在用乙酸盐喂养的反应器中,Aminicenantes和Thermovirga是主要的细菌(图5a)。到目前为止,只有三个Aminicenantes基因组已被测序,并且没有该谱系的培养代表。然而,已经在氨基酸类物种中鉴定了甲酸脱氢酶(即,氢化酶-3和甲酸氢化酶)的推定基因,并且可以将甲酸转化为氢和二氧化碳作为发酵的终产物(Robbins等,2016)。一个OTU聚集到Aminicenantes还报道了反向使用Wood-Ljungdahl途径消耗乙酸盐并产生与Methanomicrobiales的氢营养型产甲烷菌形成共生的CO 2(Gies等,2014)。如图S2所示,氨基苯甲酸酯的功能与Syntrophobacter紧密聚集,后者可能对VFA的同种异体降解有贡献。
Thermovirga占GAC0和GAC5用醋酸盐喂养的总OTU的45%和21%。Thermovirga与Aminivibrio,Acetothermia一起在Synergistetes 门下连接到Synergistaceae家族。类似地,一些鉴定的乙酸降解细菌属于Synergistetes,其可能是与氢营养型产甲烷菌结合的醋酸盐同位素氧化(Ito等,2011)。已经发现,鉴定出的Synergistetes组对乙酸盐的亲和力较低,乙酸利用率高于Methanosaeta样乙酸酯产甲烷菌(Ito等,2011)。因此,Methanosaeta和Synergistes集团似乎没有竞争力,但在本研究中使用的厌氧间歇反应器中合作用于波动的醋酸盐浓度。
The composition of Thermovirga was relatively low in GAC0 fed with propionate and butyrate, whereas a higher proportion of Exilispira was detected, which is affiliated to the phylum Spirochaete. Bacteria within the Spirochaetes are frequently detected in anaerobic digestion systems that treat municipal sludge, livestock wastewater and synthetic organic matters (Lee et al., 2013). The selective enrichment of Spirochaetes was reported in reactors accepting fatty acids especially acetate as substrate, suggesting the possible role of Spirochaetes in syntrophic acetate oxidation (Lee et al., 2013).
还发现,相对丰度Syntrophomonas和Smithella在丙酸的反应器,其成员是丙酸和丁酸氧化剂(含量较高Muller等人,2010,McInerney的等人,1981)。刘等人。(2011)使用基于DNA的稳定同位素探测(其中Syntrophomonas spp。)检查了稻田土壤中丁酸盐的间歇性氧化所涉及的生物。与产甲烷菌一起,Methanosarcina和Methanocella是最活跃的。似乎互补性脂肪酸氧化群体对接种源敏感。
如表S3所示,污泥样品中古菌的相对丰度范围为21%至61%。相比之下,Methanosaeta,甲烷,甲烷和Methanolinea是在富集培养降解的VFA主导古细菌物种,如图图5湾 Methanosaeta是典型的乙酸弹性产甲烷菌,而Methanobacterium和Methanolinea属于氢营养型产甲烷菌。Methanosarcina 使用H 2 / CO 2,乙酸盐和甲基化的一碳化合物通过三种途径产生CH 4(De Vrieze等,2012)。
一方面,尽管选择性富集的古菌在具有不同底物的反应器中不同,但Methanosaeta在所有反应器中占主导地位(图 5b),并且Methanosaeta的相对丰度遵循乙酸盐>丁酸盐>丙酸盐的趋势(图 6a ) 。在醋酸盐反应器中,Methanosaeta归因于约80.7%的产甲烷菌(HAc0),同时在丙酸盐和丁酸盐反应器中,它占42.8%和44.8%。赵等人。(2016)还报道了Methanosaeta物种以丁酸盐或丙酸盐为基质占优势。Methanosaeta的丰富度很高 可能与乙酸盐的合适浓度有关(最大68 mM),也可能消耗丙酸盐或丁酸盐氧化成乙酸盐的电子。
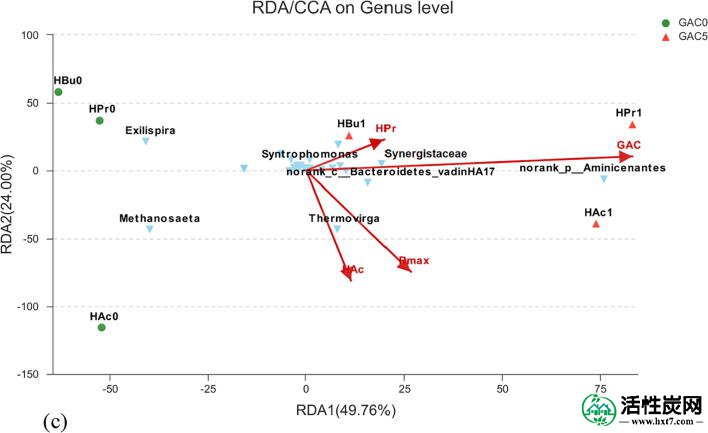
HAc,HPr和HBu(a)组之间以及0 g / L和5 g / L GAC(b)组之间微生物群落的差异分析,以及微生物群落汇聚环境因子的代表性差异分析GAC,R max和VFA浓度(c)。
另一方面,与没有GAC的对照相比,具有GAC的消化器中Methanosaeta的相对丰度通常降低。对于甲烷杆菌也发现了类似的趋势。而Methanosarcina和Methanolinea的丰度增加。据报道,Methanosarcina的存在可以很快消除酸度积累的负面影响,并以高性能产生甲烷(Wang等,2017)。对于数据,Methanosarcina和Methanosaeta是唯一已知通过直接接收电子以减少CO 2并产生CH 4而参与DIET的产甲烷菌。(Rotaru等,2014a,Rotaru等,2014b)。在乙醇代谢中已经很好地理解了DIET的促进机制,其具有Geobacter metallireducens和Methanosarcina barkeri的共培养物(Liu等人,2012,Rotaru等人,2014b)。总的来说,GAC5 中三种已知的氢营养型产甲烷菌(即甲醇,甲烷杆菌和甲烷八叠球菌)的比例比GAC0增加。相比之下,醋酸盐反应器中古菌群落的变化小于丙酸盐和丁酸盐反应器,这与根据不同GAC剂量的甲烷生成的类似反应动力学一致。
通过代表性差异分析(RDA)分析了各种环境因素如GAC补充,最大甲烷产率(R max)和VFA浓度对微生物群落动态的影响,如图6所示。首先,结果表明GAC的补充被认为是影响微生物群落的主要环境因素。HAc1和HPr1和HBu1的分布与GAC的方向相同,而HAc0,HPr0和HBu0位于相反的坐标上。此外,丰富的互生细菌,如Aminicenantes,Thermovirga,Synergistaceae和Syntrophomonas也与GAC的方向相同,而Methanosaeta则是相反的坐标,这与上述观察结果一致。对于数据,只有Methanosarcina和Methanosaeta是已知的产甲烷菌,通过直接接收电子以减少CO 2并产生CH 4来参与DIET (Rotaru等,2014a)。
Geobacter也被称为参与DIET的一种重要细菌属,其占约数量。20%的社区依附于生物炭(Zhao等,2016)或GAC(Lee等,2016)。李等人。(2016)发现从附着于GAC的生物质中富集外生电子,例如Geobacter和氢营养型产甲烷菌(例如Methanospirillum和Methanolinea)。然而,在这项研究中,在GAC污泥中检测到的集群到Geobacter的OTU 非常低(<1%的总细菌)。之前已经报道过类似的结果(Xu et al。,2015,Dang et al。,2017,巴鲁阿和达尔,2017年)。因此,正如所建议的那样,其他生物而非Geobacter也可能参与饮用产甲烷菌的饮食(Kato等,2012)。
最后但并非最不重要的是,同心氧化细菌和产甲烷菌相对于底物的相对浓度也应该受到关注(Ferguson等,2016)。如图所示图4 e和f,乙酸的积累相对较低时GAC浓度非常低,而当GAC浓度的增加,丁酸的转化率为乙酸乙酯加速和乙酸的积累相应升高。似乎在低GAC剂量下,富含GAC表面的微生物和相关的DIET可以消除对产乙酸的抗性,并且瓶颈变成产甲烷。然而,这种推论需要进一步证明,因为在本研究中尚未完全确定中间产物。
该研究表明,在重有机负荷下,补充适当的GAC剂量可以加速丙酸盐和丁酸盐的间歇性降解。具体而言,与对照(GAC0)相比,丙酸盐和丁酸盐在5g / L GAC下的降解速率急剧增加1.5倍和4.2倍,然而当将GAC剂量进一步增加至25g /时,R max发现微小增量。L. 因此,建议在厌氧消化器中使用较低剂量的GAC,并且这种改善消化器性能的方法的经济性将是有利的。GAC有益于富营养化氧化细菌,但需要一段时间的培养,因此建议将GAC保留在连续饲养消化池中。