发布日期:2018-11-06 15:21 来源:活性炭网 作者:活性炭网 浏览数:
抽象 这项研究调查了生物炭,活性炭(AC) - 和单壁和多壁碳纳米管(SWCNTs和MWCNTs)在不同浓度(0,0.2,20和2,000 mg / kg干土壤)上的影响。 土壤 中 14 C-儿茶酚和微生物群落的 命运 。 结
天然存在的酚,其是土壤腐殖质的普遍的前体,起到转化和土壤碳和氮稳定化了至关重要的作用1,2。它们占土壤中的总溶解的有机碳的高达10%3和主要是生物聚合物木质素,微生物合成,和植物根渗出的降解的产物4,5。天然存在的酚类往往发生氧化偶合反应在土壤oxidoreductive酶(例如,过氧化物酶和漆酶)和金属氧化物(例如,Fe和Mn的氧化物)的催化下,导致它们的聚合与腐殖物质6,7,8,9。此外,酚类化合物在确定土壤中有机物的稳定性方面具有重要意义,因为它们具有抗氧化活性 10。
碳质材料,如生物炭,活性炭(AC)和碳纳米材料[例如,单壁和多壁碳纳米管(SWCNT和MWCNT)],由于其独特的物理化学,已成为许多研究工作的主题。特性(例如,大的表面积,高的微孔,和高超的吸附能力),在环境和潜在价值增加发生在补救污染的土壤和沉积物11,12,13,14,15。这些碳质材料,以土壤的应用程序可以通过植物和蚯蚓有效地改变的生物利用度和有机化合物(包括有机污染物和天然酚)的生物有效性,并且因此它们的摄取11,14,16,17,18,19,20,21,22。这些碳质材料在土壤中的吸附和的有机污染物退化的影响已被广泛研究在过去几十年11,13,14,16; 然而,相对知之甚少上天然存在的酚在土壤中的矿化和变换这些碳质材料的效果22。
儿茶酚是许多天然存在的酚的基本成分,并且被认为是腐殖质物质23的重要前体,使其能够作为天然存在的酚的代表。使用14 C示踪剂,我们检测了生物炭,AC和碳纳米管(SWCNT和MWCNTs)在对数浓度(0,0.2,20和2,000 mg / kg干土)对矿化,转化和残留物的影响的分布14在农业土壤C-儿茶酚。受这些碳质材料影响的土壤细菌群落和组成也使用16S rRNA基因的454焦磷酸测序来分析。我们使用均匀的14 C标记的儿茶酚来促进儿茶酚的命运的定位。
14 C-邻苯二酚在土壤和含碳物质上的吸附和解吸等温线如图1所示。该Freundlich模型拟合等温线数据([R 2 ≥0.98)以及(表1)。根据K F和K d值,14 C-儿茶酚对碳质材料的吸附量显着高于土壤,K F和K d增加如下:SWCNTs> MWCNTs> AC>生物炭>土壤(表1)。相反,归一化表面积K F和K.碳质材料的d值如下:生物炭> AC> MWCNTs> SWCNT(表1 ; 表S1)。所有等温线都表现出非线性,因为土壤和含碳材料的Freundlich n值在0.59到0.92之间变化(表1)。
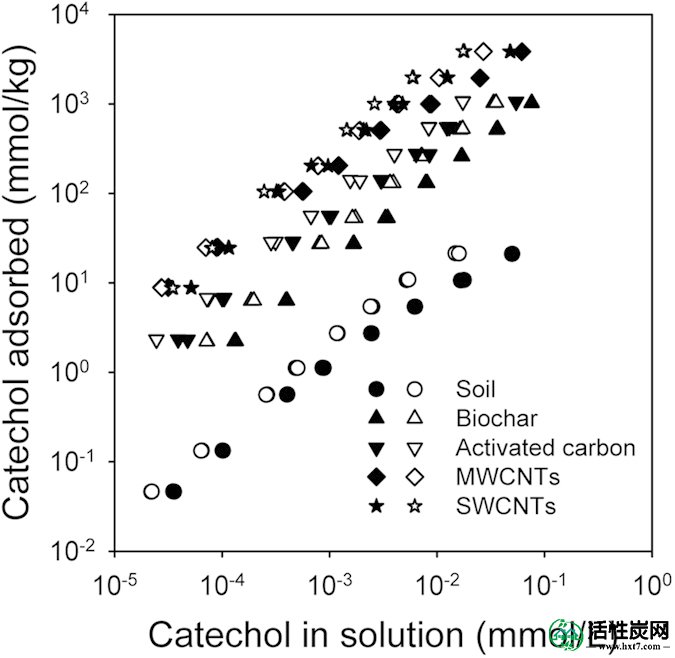
14 C-儿茶酚在土壤和各种碳质材料(生物炭,活性炭,SWCNT和MWCNT)上的吸附和解吸等温线。
| 吸附剂 |
吸附
|
解吸
|
||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| log K F(mmol1-n L n / kg) | ñ | R 2 |
记录K d
|
log K F(mmol 1-nL n / kg) | ñ | R 2 |
记录K d
|
|||
| 0.01 mmol / L. | 0.1 mmol / L. | 0.01 mmol / L. | 0.1 mmol / L. | |||||||
| 泥 | 2.55±0.07 | 0.67±0.01 | 0.99 | 3.22 | 2.89 | 3.19±0.06 | 0.74±0.02 | 0.99 | 3.71 | 3.45 |
| 生物炭 | 4.13±0.01 | 0.92±0.01 | > 0.99 | 4.28 | 4.20 | 4.51±0.02 | 0.92±0.02 | > 0.99 | 4.66 | 4.59 |
| 活性炭 | 4.28±0.08 | 0.62±0.04 | 0.98 | 5.05 | 4.67 | 4.68±0.03 | 0.91±0.01 | > 0.99 | 4.86 | 4.77 |
| 单壁碳纳米管 | 4.99±0.12 | 0.59±0.02 | 0.99 | 5.66 | 5.32 | 5.45±0.10 | 0.71±0.03 | 0.99 | 6.02 | 5.74 |
| 多壁碳纳米管 | 4.61±0.04 | 0.71±0.01 | > 0.99 | 5.28 | 4.95 | 5.06±0.04 | 0.75±0.01 | > 0.99 | 5.55 | 5.30 |
在所有情况下,解吸等温线的K F和K d值高于吸附等温线的值(表1),这意味着14 C-儿茶酚在土壤和含碳材料上的部分解吸滞后。
14 C-儿茶酚的矿化率最初较高(0-6天),逐渐减少直至实验结束(图2),并且没有表现出滞后期,表明土壤中的土着微生物能够矿化儿茶酚没有适应时间。碳质材料对14 C-儿茶酚矿化的影响取决于碳质材料的类型和添加速率(类型×加成速率相互作用:F = 5.8,P <0.001)。与对照土壤相比,添加的生物炭对14 C-儿茶酚的矿化没有影响(F = 1.4,P = 0.29)。相反,AC显着降低了14C-儿茶酚的矿化(F = 13.0,P <0.001)。对于<20mg / kg的SWCNT,没有观察到对矿化的显着影响; 然而,相对于对照土壤,2000mg / kg的SWCNT显着(P <0.05)降低了14 C-儿茶酚的矿化(图2)。当MWCNTs以0.2 mg / kg施用时,与对照土壤相比,显着更多(P <0.05)14 C-儿茶酚矿化,而浓度为20和2,000 mg / kg的MWCNTs不影响14 C-儿茶酚的矿化。土壤(图2)。
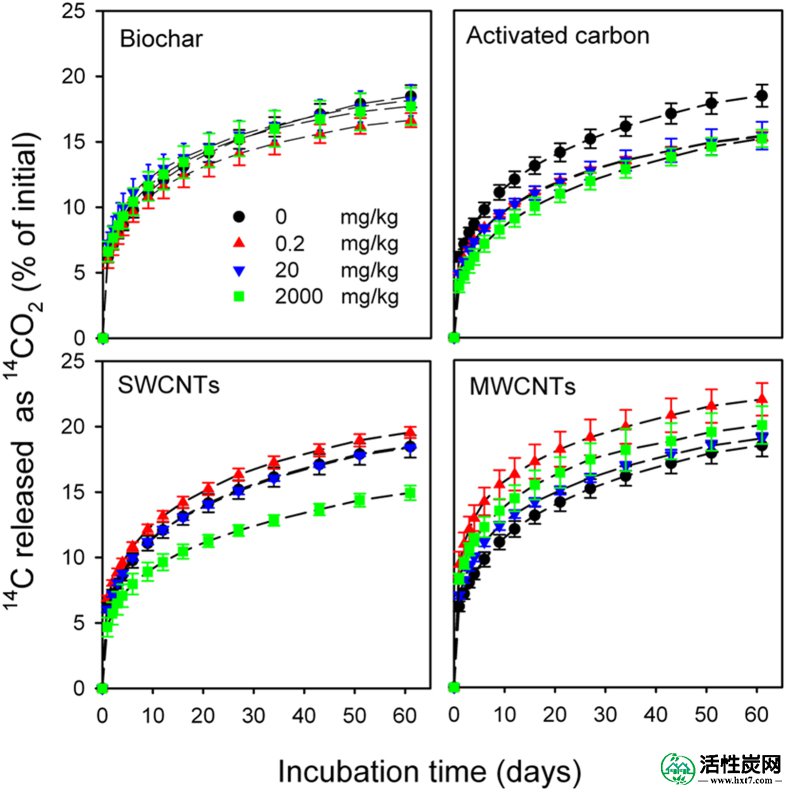
在没有碳质材料(0 mg / kg)的土壤中,14 C-邻苯二酚累积释放14 CO 2,在25℃孵育的61天内,在含有不同浓度(0.2,20和2,000 mg / kg)碳质材料的土壤中累积释放C。值是具有标准偏差的平均值(n = 3)。
表2总结了将14种 C-儿茶酚衍生的残基掺入溶解的有机物(DOM)中,各种腐殖质组分中的14 C残基分布和总放射性回收率。总放射性回收率为90.9%至95.5%,平均为93.8%,证实本研究中使用的提取和测定程序是充分的。掺入14中的C控制土壤成DOM是可忽略的低(<0.3%),并仅通过显著的SWCNT在2000毫克/千克(0.7%)(受影响表2)。碳质材料对14的分布的影响各种腐殖质组分中的C残基取决于碳质材料的类型和添加速率(类型×加成速率相互作用:F = 2.6,P = 0.015)。与对照土壤相比,生物炭和SWCNT在所有情况下对各种腐殖质成分中的14 C残留量没有影响,而2000 mg / kg的AC显着(P <0.05)增加了14 C 的含量。不溶性胡敏素组分(表2)。相比于对照土壤,多壁碳纳米管显著(P <0.05)减少14在可溶胡敏素馏分C量在所有浓度,和显著(P <0.05)仅在2,000mg / kg时降低富里酸(FA)和腐殖酸(HA)级分中的14 C 的量(表2)。
| 治疗 | 碳质材料浓度(mg / kg) |
最初施加14 C的%
|
||||||
|---|---|---|---|---|---|---|---|---|
| 14 CO 2 | DOM | 富里酸 | 腐殖酸 | 可溶性胡敏素 | 不溶的胡敏素 | 复苏 | ||
| 控制土壤 | 0 | 18.48±0.85 | 0.26±0.06 | 23.88±0.64 | 18.19±1.04 | 16.26±0.88 | 17.54±1.08 | 94.61±2.12 |
| 生物炭 | 0.2 | 16.65±0.54 | 0.32±0.04 | 25.15±0.12 | 17.51±0.77 | 16.71±0.47 | 17.05±0.28 | 93.39±1.80 |
| 20 | 18.17±1.18 | 0.30±0.04 | 23.99±0.94 | 18.00±0.30 | 15.62±0.82 | 17.66±0.44 | 93.74±0.71 | |
| 2000 | 17.72±1.42 | 0.46±0.11 | 24.05±0.59 | 17.64±1.63 | 15.52±0.68 | 15.54±2.14 | 90.93±1.62 | |
| 活性炭 | 0.2 | 15.37±0.33 | 0.29±0.02 | 24.65±1.36 | 18.53±1.74 | 15.95±0.28 | 17.24±0.69 | 92.04±1.73 |
| 20 | 15.43±1.07 | 0.28±0.03 | 24.93±0.48 | 19.55±0.65 | 16.29±0.78 | 17.78±0.77 | 94.27±1.26 | |
| 2000 | 15.21±0.67 | 0.20±0.03 | 24.32±0.48 | 17.38±0.21 | 17.43±0.55 | 20.44±0.92 | 94.97±0.63 | |
| 单壁碳纳米管 | 0.2 | 19.56±0.43 | 0.24±0.03 | 21.97±3.18 | 20.01±3.18 | 15.76±0.29 | 17.74±0.54 | 95.28±1.01 |
| 20 | 18.41±0.05 | 0.20±0.02 | 23.14±0.84 | 17.99±1.10 | 16.06±0.37 | 17.35±2.40 | 93.15±1.52 | |
| 2000 | 14.94±0.56 | 0.70±0.37 | 25.84±0.69 | 16.95±1.83 | 17.32±0.69 | 19.77±0.50 | 95.52±1.65 | |
| 多壁碳纳米管 | 0.2 | 22.00±1.24 | 0.26±0.02 | 23.55±0.19 | 16.89±1.28 | 14.89±0.86 | 17.59±0.85 | 95.18±1.82 |
| 20 | 19.01±0.42 | 0.28±0.03 | 23.94±0.23 | 16.58±1.42 | 14.64±0.44 | 18.54±0.69 | 93.00±1.95 | |
| 2000 | 20.03±1.44 | 0.28±0.02 | 22.53±0.23 | 15.50±0.29 | 14.99±0.30 | 19.12±4.06 | 92.45±3.76 | |
将残留的放射性分成溶解的有机物质(DOM),富里酸,腐殖酸,可溶性胡敏素和不溶性胡敏素部分。对照土壤处理的值是平均值,具有由12个单独实验计算的标准偏差,而所有其他值是具有源自三个单独实验的标准偏差的平均值。
碱性可提取的腐殖质中的14个 C-残基具有一个分子结构域,其主要分子量为580Da(图S1)。添加生物炭或SWCNT不会影响14 C残留物的分子大小分布(图S1),而AC> 20 mg / kg和MWCNTs 2,000 mg / kg时,14 C残基的主要分子略微偏向分子量较高的腐殖质(图S1)。
用不同碳质材料修正的无碳质材料土壤和土壤中土壤微生物生物量碳含量如图3所示。培养61天后,生物炭和MWCNTs修正对土壤微生物生物量C没有影响,而0.2,0,20和2,000 mg / kg的AC显着(P <0.05)使土壤微生物生物量C降低38.7%,45.8% ,分别为50.4%(图3)。对于<20 mg / kg的SWCNTs,未观察到对土壤微生物生物量C的显着影响; 然而, 当以2,000mg / kg施用SWCNT时,土壤微生物生物量C显着(P <0.05)降低了43.1%(图3)。
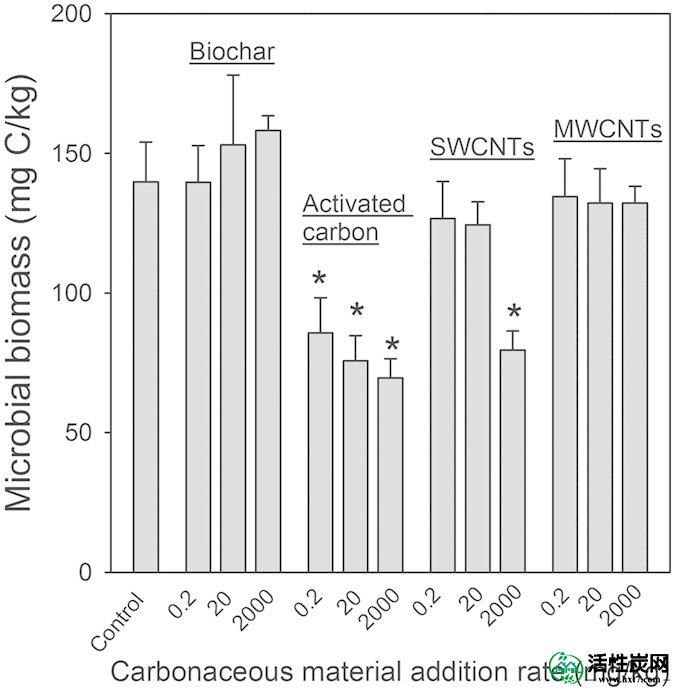
在培养61天后,碳质材料(生物炭,活性炭,SWCNT和MWCNT)对不同修正浓度(0,0.2,20和2,000 mg / kg)的土壤微生物生物量C的影响。值是具有标准偏差的平均值(n = 3)。高于平均值的星号表示与对照土壤的显着差异。
使用主要坐标分析(PCoA)说明了响应碳质材料修正的细菌群落的变化,这表明在所有情况下,除了0.2 mg / kg生物炭处理外,微生物群落结构在接触碳质材料后发生了变化(图.4A)。在生物炭的情况下,2000 mg / kg处理的细菌群落与0.2 mg / kg和对照处理的细菌群落显着不同(图4A))。在SWCNT的情况下,2000mg / kg处理明显地与对照,0.2和20mg / kg处理分开,表明2000mg / kg处理对土着微生物施加不同的压力。在所有MWCNTs处理中,群落组成明显不同于对照处理中的那些(图4A)。
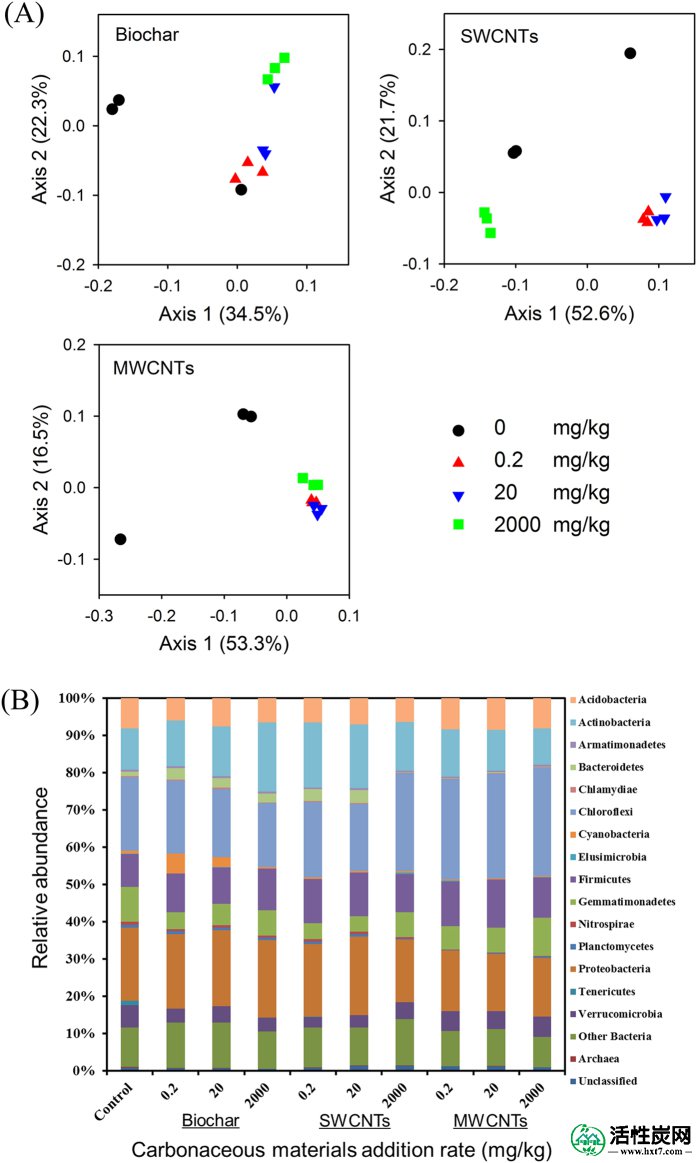
主要坐标分析(PCoA)说明了土壤细菌群落的变化,基于Bray-Curtis距离(A)和主要门(B)的相对丰度,受各种碳质材料(Biochar,SWCNTs和MWCNTs)的影响孵育61天后,修正浓度(0,0.2,20和2,000 mg / kg)。
在门阶段的社区变化表明细菌在不同组之间表现出不同的变异。系统发育分析表明,Proteobacteria,Chloroflexi,Actinobacteria和Firmicutes是土壤微生物群落中最主要的群体(图4B)。与对照处理相比, 所有碳质材料改良处理中Tenericutes和Nitrospirae的相对丰度均显着降低(P<0.05)(图S2)。 在所有生物炭修正处理中,Verrucomicrobia的发生率显着降低(P <0.05),与拟杆菌的处理相反(图S2))。 通过2000mg / kg生物炭修正,放线菌的发生仅显着(P <0.05)降低。对于SWCNTs处理,与对照相比,Verrucomicrobia,Cyanobacteria和Gemmatimonadetes的相对丰度显着降低(P <0.05)(图S2)。 在0.2和20 mg / kg SWCNTs处理中,拟杆菌和Elusimicrobia的丰度显着增加(P <0.05),但 在2000 mg / kg SWCNTs处理中显着(P <0.05)减少,相对于对照处理(图S2)。在所有MWCNTs处理中,拟杆菌的相对丰度显着(P < 0.05) 与对照组相比 ,Chloroflexi的显着(P <0.05)显着降低(图S2)。0.2和20mg / kg MWCNTs处理显着增加了厚壁菌的数量(图S2)。
14 C-儿茶酚在生物炭,AC和碳纳米管上的吸附量明显高于土壤上的吸附量(图1),表明用这些含碳物质改良土壤可能会增加14 C-儿茶酚对土壤的吸附亲和力。此吸附行为很可能由Freundlich模型进行说明(图1),并与在这些碳质材料儿茶酚吸附的先前研究一致19,20,24,而在观察到更高的线性度指数(0.59-0.92)我们的研究比以前的研究。
在该研究中观察到14 C-儿茶酚在土壤和碳质材料上的解吸滞后,表明儿茶酚的吸附是部分可逆的。碳质材料上的解吸滞后表示碳质材料在添加到土壤中后可用作14 C-儿茶酚槽(例如,仅可释放14 C-儿茶酚的可逆部分)。由于邻苯二酚具有强偶极矩,土壤上的解吸滞后可归因于与土壤有机质(SOM)25的化学键合(化学吸附),与土壤中可交换阳离子的强静电相互作用,与凝聚有机物质的夹带26和儿茶酚与SOM表面27之间的π-π力。与此相反,在碳质材料的解吸滞后可以由儿茶酚的苯环的碳质材料的表面上,以及毛细管冷凝的静电和强π-π相互作用而引起27,28。
碳质物质对土壤中有机化合物矿化和转化的影响可能有两种方式:i)通过改变土着微生物活动; 和ii)通过还原化合物的生物利用度为它们的高吸附亲合性的用于碳质材料的结果18,29,30。在AC> 0.2mg / kg和SWCNTs为2,000mg / kg时,土壤微生物生物量C显着降低,表明土着微生物生长受到抑制(图3)。这抑制了土壤微生物活动,减少了14C-儿茶酚矿化。并且在SWCNTs处理中观察到的显着变化的微生物群落结构也可以在减少14 C-儿茶酚矿化中起作用(图4A)。与我们的结果一致,据报道,> 300 mg / kg的SWCNT,无论是粉末还是悬浮液,都能显着抑制大多数土壤酶的活性,并降低微生物生物量C和N 31。在AC和SWCNT存在下抑制微生物生长和微生物活动可归因于AC和SWCNT修正引起的土壤理化过程改变,如无机和有机化合物(包括酶)的吸附,土壤水分保留的变化和孔隙结构32。
AC和SWCNTs在2000 mg / kg时对14 C-儿茶酚的矿化作用减少也可能是由于AC和SWCNTs修复土壤中生物利用度降低的结果,因为14 C-儿茶酚在AC和SWCNT上的吸附量远远高于AC和SWCNTs。在土壤上,吸附只是部分可逆的(图1)。许多研究已经证实,AC和单壁碳纳米管的修正可以显着通过充当强吸附剂,从而导致减少在土壤和沉积物疏水性有机污染物的矿化和耗散减少疏水性有机污染物的生物利用度和生物有效性14,29,33,34,35。
与AC处理相比,生物炭修正不会显着影响14 C-儿茶酚矿化(图2 ; 表2),即使生物炭中儿茶酚的吸附仅略低于AC。通常,只有游离的或容易解吸的化合物才能被土壤微生物接近和降解; 然而,最近的研究已经表明,土壤中的微生物也可直接降解化合物,即使它们已经吸附到炭黑(例如,木炭)的表面36,37。土壤微生物生物量C不受生物炭修正的影响,反映出土壤微生物的生长可能不受生物炭修正土壤的限制(图3)。
在> 20 mg / kg的MWCNT和土壤中14 C- catchol矿化的对照土壤之间没有观察到显着差异(图2)。因此,这些浓度的MWCNTs对儿茶酚降解微生物的活性没有显着影响,并且儿茶酚对儿茶酚降解剂的生物可接受性也不受MWCNTs存在的影响,即使MWCNTs对邻苯二酚相对的吸附能力要高得多。到土壤。MWCNT修正对微生物生物量C的影响支持这种推测,因为MWCNTs修正不会影响微生物生物量C与对照土壤相比(图3))。根据我们的结果,显示MWCNTs修正值高达1,000 mg / kg对土壤呼吸,酶活性和微生物群落组成没有影响38。在用特定细菌降解物土壤杆菌修正的沉积物中,微生物活性也不受MWCNTs 5%添加速率的影响,导致14 C-菲37快速发生矿化。此外,多壁碳纳米管具有高吸附亲合力,以溶解的有机物质(例如,腐殖酸,蛋白胨和α -苯丙氨酸)39。通过将溶解的土壤有机物质吸附到MWCNT上,可以显着降低儿茶酚可用于儿茶酚的表面上的吸附位点的数量,从而导致土壤中儿茶酚的生物可接受性不受MWCNT存在的显着影响。令人惊讶的是,0.2mg / kg的MWCNT显着刺激了土壤中14 C-儿茶酚的矿化(图2 ; 表2)。MWCNTs以0.2 mg / kg刺激的原因可能是由于土壤微生物群落结构的交替,这些结构在所有修正率下都对MWCNTs敏感(图4A))。最近的研究已经表明,细菌属拟杆菌,厚壁菌门,红球菌属,纤维单胞,诺卡氏菌属和假单胞菌属,这被认为是顽固的污染物的潜在作用的降解的丰度,在多壁碳纳米管的存在下增加38,40。在本研究中,对于0.2和20mg / kg MWCNTs处理,厚壁菌门的相对丰度也显着增加(图S2)。
由于14 C-儿茶酚对SWCNTs和MWCNTs 的吸附大致相同,SWCNTs和MWCNTs对14 C-邻苯二酚矿化的不同影响主要归因于它们对土壤微生物群落结构和活性的不同影响。SWCNT对细胞的毒性比MWCNTs更大,尽管SWCNT和MWCNTs都可以渗透到细胞的细胞质和核膜中,导致细胞死亡增加41。单壁碳纳米管也被示出为在抑制酶活性和微生物生物质C和N更有效,由于单壁碳纳米管比多壁碳纳米管的更高的表面积31。
孵化结束时14 C残留物(> 70%)的大部分放射性残留在土壤腐殖质成分中(表2); 其中,胡敏素组分(即可溶性和不溶性胡敏素组分的总和)占优势,其次是FA和HA组分。在其C和O含量以及官能团42的量方面,胡敏素部分与FA和HA部分不同。Humin级分更亲脂并含有具有高表面积的有机粘土复合物43,这可以为14 C残基提供更多的吸附和掺入位点,并促进14 C残基掺入胡敏素级分中。纳入14的C残基到胡敏素表示的稳定化14的C残基,因为是胡敏素顽抗和表示SOM的稳定期42,44。本研究中土壤中14 C残留物的稳定化是通过将14 C残留物与土壤有机和无机成分结合而发生的,与先前研究的结果一致,其中超过70%的14 C-儿茶酚衍生残留物是并入胡敏素的级分22,45。
在测试的含碳材料中,MWCNT 对腐殖质组分中14 C残基的分布影响最大,2,000 mg / kg MWCNT显着降低了FA,HA和可溶性胡敏素组分中的14 C残基。AC修正具有下一个最大的影响,相对于对照土壤中的水平,在2,000mg / kg AC存在下,不溶性humin级分中的14 C残基显着增加(表2)。多壁碳纳米管和AC修正案在2000毫克/千克的影响可以被反映在的分子大小分布的变化14的C残基。在MWCNTs和AC修正剂(2,000 mg / kg)存在下,分子大小为14C残基向腐殖质内的较高分子量移动(图S1)。
通常,天然存在的酚易于在土壤中经受生物和非生物转化,导致其酚结构通过共价键合聚合成腐殖质46。因为土壤有机(腐殖物质)和无机组分(例如,金属氧化物和粘土矿物)具有用于大相互作用亲和力14 C-儿茶酚4,6,7,的生物降解和转化14 C-儿茶酚可以通过其相互作用来确定与土壤成分而不是碳质材料的存在。这可以解释为什么生物炭和SWCNTs修正案对14号没有影响各种腐殖质成分中的C残留物(图S1 ; 表2)。这些结果表明,碳质材料改良剂在土壤中14 C-儿茶酚衍生残留物的稳定化过程中起了次要作用。
总之,我们的研究结果表明,不同的碳质材料可能对14 C-儿茶酚在土壤和土壤微生物多样性中的命运产生不同的影响。与AC和CNT相比,生物炭对土壤中14 C-儿茶酚的命运影响较小。随着生物炭,AC和碳纳米管向环境的潜在释放随着其应用的增加而增加,我们的研究结果对于理解14 C-儿茶酚在这些碳质材料存在下的命运具有重要意义。由于预测土壤中CNT的平均浓度(0.01-0.02μg/ kg)远低于本研究中使用的平均浓度47,因此CNTs(0.2-2,000 mg / kg)对矿化和转化的影响为14C-儿茶酚在CNT污染土壤的“热点”区域可能是重要且相关的。然而,这些结果为评估碳纳米管在土壤中的潜在风险和影响时的最坏情况提供了有用的信息。进一步的研究应该集中在特定的儿茶酚降解剂在14 C- catehcol 矿化中的作用,通过纯培养依赖性评估和功能基因分析。
从中国江苏省如东市外的农田(5-15厘米深)收集原始土壤。将新鲜土壤样品筛分至小于2mm并分成两部分:将一部分风干以进行化学性质分析和吸附实验,另一部分用于孵育实验。土壤的pH为6.8(0.01M CaCl 2),总有机碳含量为0.9%。其砂,淤泥和粘土含量分别为12.9%,76.1%和11.0%。
Cunninghamia lanceolata的锯末用于在氧气限制条件下在马弗炉中生产生物炭。起始热解温度设定在400℃,保持恒定4小时。将得到的生物炭在炉内冷却至室温。分析级粒状AC购自Huangkang Chemical Co.,Ltd。(中国上海)。在实验之前,将生物炭和AC机械研磨并筛分至小于1mm。碳纳米管(SWCNT和MWCNT)购自Shenzhen Nanotech Port Co.Ltd。(中国广东省深圳市)。SWCNT和MWCNT的外径分别<2nm和10-20nm。使用Brunauer-Emmett-Teller(BET)氮吸附技术在77K下评估生物炭,AC,SWCNT和MWCNT的比表面积和孔径分布。通过元素分析仪(Elementar Vario EL III,Germany)测定生物炭,AC,SWCNT和MWCNT的元素丰度。这些碳质材料的特征总结如下表S1。
具有> 99%放射化学纯度的均匀14 C-标记的儿茶酚(14 C-儿茶酚)购自American Radiolabeled Chemicals(Saint Louis,MO,USA),具有2.82GBq / mmol的比放射性。未标记的儿茶酚(> 99%纯度)购自Sigma Incorporation(中国上海)。
在具有Teflon衬里的螺旋盖的玻璃小瓶中进行吸附实验,所述螺旋盖含有一定量的吸附剂(土壤为1,000mg,生物炭和AC为20mg,SWCNT和MWCNT为5mg)。将在0.01M CaCl 2中制备并含有200mg / L NaN 3的二十二毫升0.1-100mg / L 14 C-儿茶酚溶液加入到小瓶中。然后将小瓶在垂直旋转振荡器上在25℃在黑暗中轻轻摇动5天。我们的初步实验表明,五天是达到吸附平衡的足够持续时间。摇动后,将小瓶以2,500g离心15分钟,取0.5mL上清液测定14小时。C-儿茶酚使用液体闪烁计数器(LSC)。在小瓶中不含吸附剂的对照实验表明,在吸附实验期间,14 C-儿茶酚的损失可忽略不计。所有吸附实验均一式两份进行。
通过用含有200mg NaN 3的0.01M CaCl 2溶液替换90%的上清液,在吸附实验后立即进行解吸实验。将所有小瓶在25℃下在黑暗中摇动5天,并以2,500g离心15分钟。使用LSC再次测定上清液中的14 C-儿茶酚。
孵育实验在100mL具有橡胶塞和2g新鲜土壤(干重)的玻璃小瓶中进行。将1毫升含碳物质(生物炭,AC,SWCNT和MWCNTs)悬浮液加入到不同浓度(0.004,0.4和40毫克/毫升)的小瓶中,并与土壤充分混合,导致各种碳质物质浓度降低。土壤(0.2,20和2,000毫克/千克)。根据Zhou 等人的方法制备碳质材料的悬浮液。(2013)29。一个14然后将C-儿茶酚水溶液(100μL,356.2kBq / mL和13.9μg/ mL)加入到玻璃小瓶中并与土壤 - 含碳材料基质充分混合。将土壤水分调节至最大持水量的60%,并将土壤 - 碳质材料基质再次充分混合。将所有小瓶在25℃下在黑暗气候室中孵育61天。在培养期间,从土壤中释放的14 CO 2被闪烁小瓶中的1mL 1M NaOH吸附,该小瓶悬浮在橡胶塞的底部。含有1M NaOH的闪烁瓶定期更换,放射性为14 CO 2使用LSC测量NaOH溶液中的溶液。所有孵育试验一式三份进行。
在培养结束时,将土壤样品分成DOM和各种腐殖质组分,通过高效放射性凝胶渗透色谱(HP- 14C-GPC)分析14 C-儿茶酚衍生残基的分子大小分布。放射性的量化由LSC进行(参见补充信息)。
为了评估碳质材料对土壤微生物生物量C的影响,将15克新鲜土壤(干重)放入100毫升玻璃瓶中,然后加入0.75毫升不同浓度的碳质材料悬浮液(0.004,0.4和将40mg / mL)加入小瓶中并与土壤充分混合。这导致土壤中的各种含碳物质浓度(0.2,20和2,000mg / kg)。将土壤含水量调节至最大持水量的60%,并用Parafilm覆盖小瓶以在整个培养期间保持土壤水分。每四天加入蒸馏水补偿蒸发。将所有小瓶在黑暗中于25℃温育61天。所有孵育试验均进行六次。
在温育结束时,使用氯仿熏蒸提取方法48测定土壤中的微生物生物量碳。生物质C的分数使用0.45的值。将一半小瓶用不含乙醇的氯仿熏蒸24小时。通过摇动1小时,用60mL 0.05MK 2 SO 4提取未熏蒸和熏蒸的土壤,然后过滤。使用TOC分析仪(Multi N / C 2100,Jena,Germany)测定提取物中的C含量。土壤微生物生物量C计算为
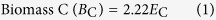
其中,E C等于从熏蒸土壤中提取的有机碳(mg / kg)减去从非熏蒸土壤中提取的有机C(mg / kg)48。
在孵育实验中于61天收集1g潮湿土壤样品的等分试样。基于制造商的说明,使用用于土壤的FastDNA旋转试剂盒(MP Biomedicals)从0.5g土壤样品中提取微生物基因组DNA。使用NanoDrop分光光度计(NanoDrop Technologies,Wilmington,DE,USA)检查DNA的质量和数量。在AC修正处理的情况下,DNA中总核酸的纯度和浓度不足,因此未进行AC修正处理的进一步分析。通过分析如Wu 等人先前描述的16S rRNA基因的V4区域,在Roche 454 GS FLX仪器(Roche Diagnostics Corporation,Branford,CT,USA)上进行扩增子焦磷酸测序。(2013)49。标记的515f和907r引物用于扩增16S rRNA基因的V4区域。将每个样品的一式三份PCR扩增子合并,纯化,并以等摩尔比组合成单管,准备进行焦磷酸测序分析(参见补充信息)。
14 C-儿茶酚在土壤和含碳物质上的吸附 - 解吸数据符合Freundlich等温线(方程式2):
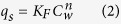
其中,q s(mmol / kg)和C w(mmol / L)分别是吸附剂(土壤和含碳材料)和平衡水溶液中14 C-儿茶酚的浓度。K F是Freundlich亲和系数(mmol 1-n L n / kg),n是Freundlich线性指数(无量纲)。使用Sigma Plot 11.0软件的非线性回归函数将数据拟合到Freundlich模型。
计算各种浓度下的固 - 水分配系数(K d,L / kg)
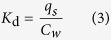
统计分析用SPSS 16.0软件进行,显着性水平设定为P = 0.05。的碳质材料处理上的累积的影响14CO 2,14下,在DOM,14使用双向方差分析(ANOVA)分析各种腐殖质组分和土壤微生物生物量C中的C. 碳质材料(生物炭,AC,SWCNT和MWCNT)的类型和添加速率(0,0.2,20和2,000mg / kg)用作两个独立变量。并且通过SPSS16.0软件包中双向ANOVA分析的“受试者间效应测试”功能评估碳质材料类型与添加率之间的相互作用。使用SPSS 16.0中的一般线性模型获得双向ANOVA 的显着性水平和F值。