发布日期:2018-11-09 10:59 来源:活性炭网 作者:活性炭网 浏览数:
生物炭是一种类似木炭的有机物质不完全燃烧产物,是一种越来越受欢迎的土壤改良剂,旨在提高土壤肥力。 我们研究了生物炭可能以类似于先前报道的颗粒活性炭(GAC)的方式促进直
生物炭,这是由与氧供应有限的封闭系统中加热生物质产生的,已被晋升为修订改善土质1,2,但了解甚少生物炭对土壤微生物社区的影响。生物炭已被用于提高土壤肥力3,修复污染,减少温室气体排放4,并在世界范围内寻求实现碳中和4碳封存4。生物炭被假设通过在其表面浓缩有机底物和营养素来增加微生物土壤含量5。可能影响土壤微生物群活动的生物炭的另一个特征是生物炭是导电的6。导电矿物/材料,如磁铁矿或GAC促进DIET通过加速无氧代谢的速率7,8,9,10。在某些条件下,DIET被认为是比策略种间电子转移可能更有效,如种间ħ 2或甲转移依赖于物种之间的电子载流子的扩散11,12。
饮食已在经由诸如菌毛生物电连接的情况下的导电材料被证明可能13,14,15,16,17。例如,Geobacter metallireducens和Geobacter sulfurreducens在培养基中通过DIET在乙醇作为电子供体和富马酸盐作为电子受体13的培养基中生长。这两种生物需要合作才能代谢乙醇并生长,因为G. metallireducens可以利用乙醇作为电子供体,但不能使用富马酸作为电子受体18,而G. sulfurreducens不能用乙醇作为电子给体,但可以减少电子受体,富马酸19。在共培养,G. metallireducens从乙醇产生乙酸和G.硫还原利用从乙醇氧化以及用于富马酸还原所产生的乙酸酯释放的电子13。多条证据13,14,15,16,17显示,在物种间电子转移地杆菌共培养物中经由DIET而不是H进行2或甲转移,并且所述地杆菌菌毛,其posses类似金属的导电性20,21,DIET期间必需的。
然而,Geobacter共培养物通过菌毛介导的DIET对种间电子转移的初步适应需要大约1小时。30天13。GAC通过DIET大大缩短了适应生长期,乙醇代谢在第9天就明显了。此外,在GAC存在下DIET的机制似乎是不同的,因为缺乏菌毛或菌毛相关细胞色素OmcS 的G. sulfurreducens菌株在没有GAC 13的情况下不能进行DIET ,但功能和野生 -在有GAC 9的情况下输入。而不是在没有GAC 13时观察到的形成紧密的细胞间连接两种物质都附着在导电GAC上,这表明GAC作为电子供给电子和电子接受细胞之间电子流动的细胞间导管。GAC还加速了G. metallireducens和M. barkeri之间的电子转移,促进了乙醇产生甲烷,如果厌氧废水消化池中的聚集体用GAC 9进行修正,则观察到甲烷产量增加。
生物炭,是一种前体GAC 22和化学或生物炭产率的物理活化GAC,具有较高的表面积,孔隙率和增加的芳香23,24。通过固体导电介质的电子传导与穿梭的分子扩散基本上不同。通过固体材料的传导涉及电子的迁移以响应电压电势的差异,而浓度梯度驱动梭子的扩散。术语电子穿梭通常是指可溶性分子,例如腐殖质25,半胱氨酸26,氧化还原活性金属27或黄素28。由于浓度梯度,它可以接受来自一种微生物的电子并将它们捐赠给另一种电子受体29。
在这项研究中,我们讨论了生物炭对基于DIET的营养关系的影响。同步关联是环境中碳循环的根源,本报告揭示了生物炭作为环境中甲烷排放的潜在贡献因素。我们对生物炭的中所定义的共培养与影响研究报告G. metallireducens通过种间H,有效微生物用于评估饮食,因为它可以通过DIET供给电子,而不是2或甲转移13,14,16,18。
将生物炭添加到G. metallireducens和G. sulfurreducens共培养基中,乙醇作为电子供体,富马酸盐作为电子受体,刺激乙醇的同质代谢(图1A),富马酸盐还原为琥珀酸盐(图1B)两天之内。与此相反,的控制共培养G. metallireducens和G.硫还原,不与生物炭,需要约修正 30天适应乙醇代谢13。使用生物炭水溶性提取物的乙醇损失和琥珀酸生产率仅比无生物炭控制略快(图1)),表明生物炭的颗粒部分主要负责刺激共培养代谢。
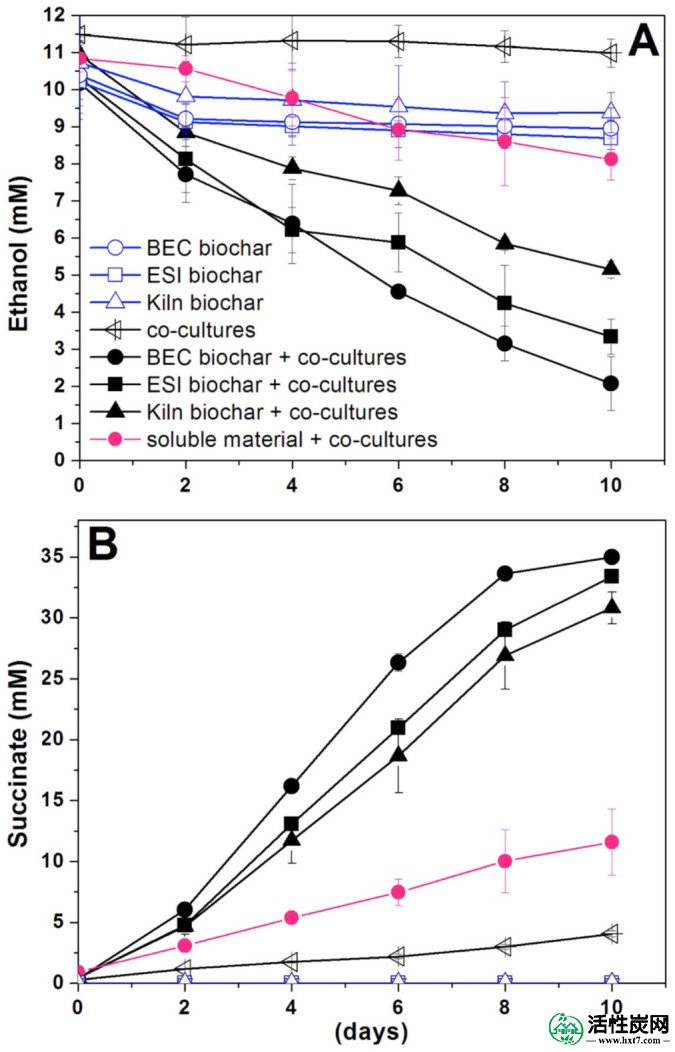
(A)乙醇消耗和(B)通过G. metallireducens和G. sulfurreducens的共生共培养物与不同类型的生物炭生产琥珀酸盐。作为对照实验,我们测试了所有不含细胞的不同生物炭,没有生物炭的共培养物和与生物炭释放的可溶性组分的共培养物。误差棒表示一式三份培养物的平均值的标准偏差。
乙醇代谢率随着生物炭类型的不同而有所不同,但这与电导率的微小差异无关,因为用ESI生物炭修正共培养物,其具有最低的电导率(表1),代谢乙醇的比率介于两者之间。 BEC和窑生物炭,两者都具有电导率。高出2倍。在生物炭存在下乙醇代谢的快速速率与先前用相同量的GAC 9观察到的速率相当。然而,用相同的方法9测量的GAC电导率(3000±327μS/ cm)显着高于生物炭的电导率(表1))。另一方面,非导电材料玻璃珠在类似条件下不促进DIET 9。在用生物炭乙酸盐修饰的共培养物中没有积累,因此每摩尔乙醇氧化成二氧化碳与富马酸盐(G. sulfurreducens的电子受体)的还原相结合,并且预计会产生六个。琥珀酸的摩尔数(反应1)。
| 生物炭 | 原料 | 热解温度(°C) | 粒径(mm)a | BET表面积(m 2 / g)b | 每g生物炭的电导率(μS/ cm)c |
|---|---|---|---|---|---|
| BEC | 松树 | 700秒30秒,500秒15分钟 | ≤0.4 | 15 | 4.41 |
| ESI | 松树 | 500小时2小时 | ≤1 | 167 | 2.11 |
| 克林 | 松树 | 600小时2小时 | ≤3 | 209 | 4.33 |
a通过透射电子显微镜检查估算最大粒径。
b Brunauer-Emmett-Teller(BET)表面积是使用Quantachrome Autosorb-1 41从77 K的N 2吸附获得的。
c如前所述20用双电极系统测定电导率。
C 2 H 6 O + 6 C 4 H 4 O 4 + 3 H 2 O→2 CO 2 + 6 C 4 H 6 O 4(反应1)
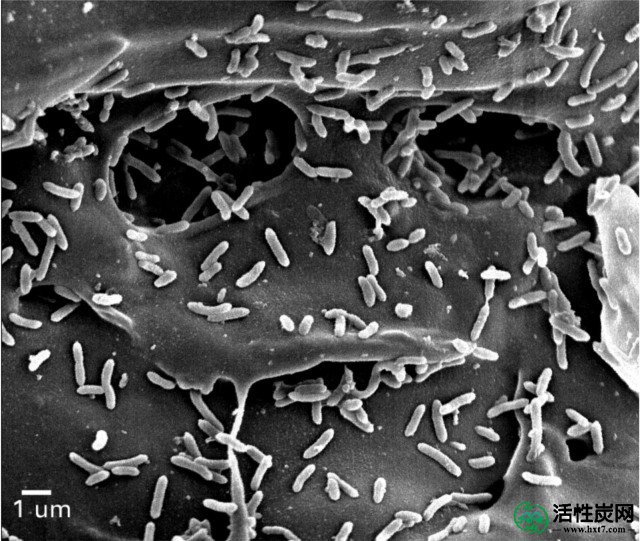
在BEC,ESI和窑生物炭存在下,培养10天内产生的乙醇和琥珀酸的量(平均值±标准偏差; n = 3)为8.10±0.72 / 34.98±0.48; 6.98±0.47 / 33.37±0.24; 和5.15±0.23 / 30.81±1.28。因此,富马酸盐还原为琥珀酸盐占电子的72-88%,这些电子来源于生物炭修正培养物中的乙醇去除。在用生物炭修正的共培养物中,大部分(78%)共培养蛋白在孵育10天后牢固地附着在生物炭的固体颗粒上(图2A)。附着细胞的定量PCR分析表明大多数(69%)是G. sulfurreducens(图2B)。扫描电子显微镜显示附着的细胞不像没有生物炭的共培养物那样形成聚集体(图3),这表明细胞之间的直接生物学连接是不必要的。
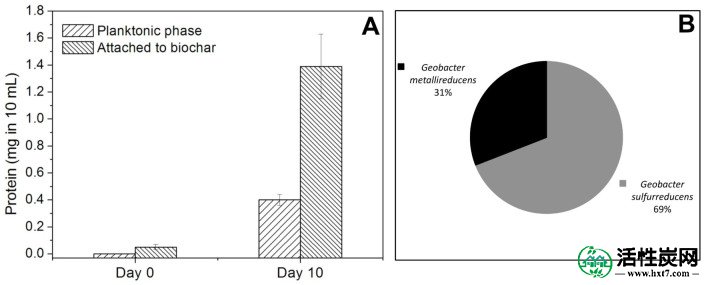
(A)在第0天和第10天在浮游阶段的10mL培养基中的蛋白质并附着于BEC生物炭,和(B)在第10天在G. metallireducens / G中附着于BEC生物炭的细胞的定量PCR分析。.sulfreducensns共培养。误差棒表示一式三份培养物的平均值的标准偏差。
仅由G. metallireducens组成的培养物缓慢代谢乙醇,相应地增加乙酸盐(图4A),表明生物炭充当电子受体(反应3)。
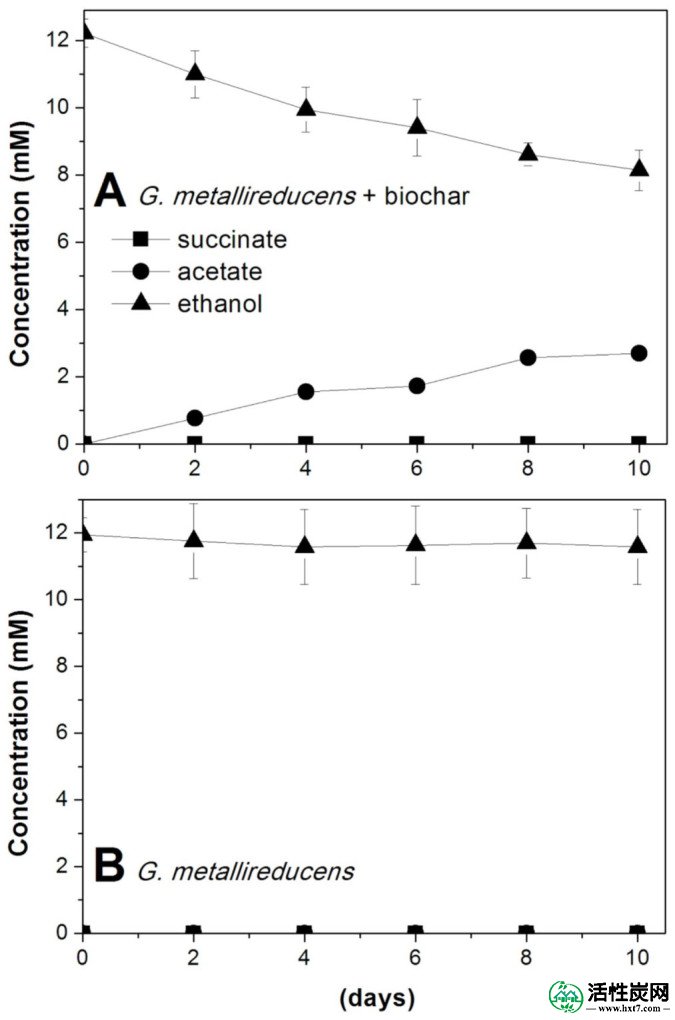
乙醇作为电子给体的培养基中乙醇消耗,琥珀酸和乙酸盐的产生,其中(A)G。metallireducens和BEC生物炭或(B)单独的G. metallireducens。误差棒表示一式三份培养物的平均值的标准偏差。
C 2 H 6 O + H 2 O +(Biochar ox。)→C 2 H 4 O 2 + 4H + + 4 e -(Biochar red。)(反应2)
在不存在生物炭的情况下没有乙醇代谢(图4B)。
从10天内代谢的乙醇量(2.8mmol / L×0.01L = 0.028mmol),以及从乙醇代谢到乙酸盐(4mmol电子/ mmol乙醇)的电子释放的化学计量,可以估计0.25g培养管中的生物炭接受来自G. metallireducens的 0.112毫摩尔电子。每克生物炭接受0.5毫摩尔电子。这相当于一克土壤腐殖质在微生物还原过程中能够接受的0.35毫摩尔电子30。然而,与腐殖物质,一旦降低,可以提供电子与Fe(III)25,31当还原的生物炭暴露于柠檬酸铁(III)时,没有Fe(III)被还原,这表明,如先前对GAC 9的证明,通过生物炭的电子传输不太可能归因于醌部分,而是归因于导电性质。的材料。我们的生物还原生物炭的Fe(III)柠檬酸盐实验是在生理条件下(pH 6.5-7.0)进行的,这与以前的研究不同,该研究报道减少的活性炭37可以在低pH条件下还原柠檬酸铁(III)37。
一些产甲烷社区可以经由DIET交换电子16,32。最近在与G. metallireducens和Methanosaeta harundinacea 16的共培养研究中证实了DIET ,该研究还证明了G. metallireducens无法产生H 2或甲酸盐以通过H 2 /甲酸盐利用来提供CO 2还原成甲烷的电子。产甲烷伴侣如甲烷螺菌(Methanospirillum hungatei)或甲烷杆菌(Methanobacterium formicicum)16。导电材料对定义系统中的DIET和产甲烷作用的影响从共培养的研究中显而易见G. metallireducens和M. barkeri用GAC 9修订。修正G. metallireducens和M. barkeri与生物炭的共培养物刺激乙醇转化为甲烷(图5A)。乙酸盐存在短暂积累,但甲烷产生依赖于反应2后的乙醇代谢。
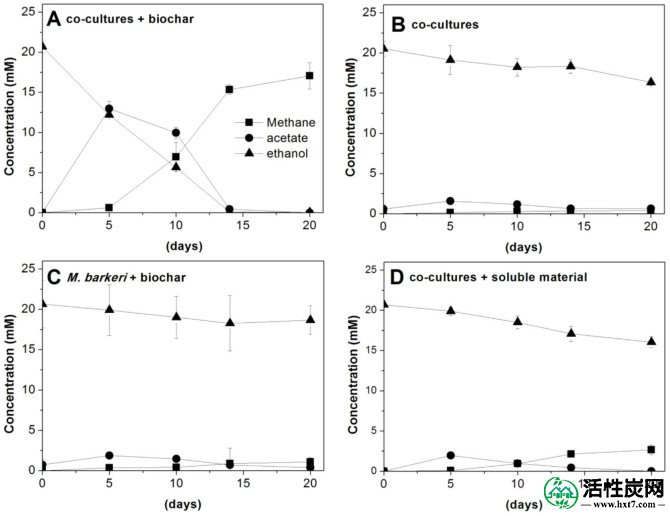
在(A)G.metalireducens-M的共培养物中乙醇消耗,甲烷和乙酸盐的产生。具有BEC生物炭的巴克菌,(B)G.coilireducens-M的未修饰的共培养物。巴斯德氏菌(C)和巴氏芽孢杆菌与BEC生物炭的纯培养物,和(D)G.metalireducens-M的共培养物。巴克与来自生物炭BEC释放的可溶性组分。误差棒表示一式三份培养物的平均值的标准偏差。
2 CH 3 CH 2 OH→3 CH 4 + CO 2(反应3)
在生物炭的存在下,21±1mM乙醇(即在10ml培养基中210μmol)的代谢产生16±2mmol / l甲烷(即在17ml顶空中272μmol)。因此,来自乙醇代谢的86%的电子在甲烷中被回收。相反,G。metallireducens-M中没有乙醇代谢或甲烷产生。在不存在生物炭的情况下(图5B)或在生物炭存在下单独使用M. barkeri的巴西(Bacer)共培养物(图5C)。水溶性生物炭部分对G. metallireducens-M中的乙醇代谢仅具有轻微的刺激作用。巴克菌共培养物,表明固相是主要的刺激成分(图5D)。
与Geobacter共培养物类似,大多数细胞蛋白(71%)与产甲烷共培养物中的生物炭颗粒牢固相关(图6A),87%的附着细胞是G. metallireducens(图6B)。与M. sulfurreduce的共培养相比,与M. barkeri共培养的G. metallireducens的丰度更高可能是由于M. barkeri与G. sulfurreducens的生物体积较大,从SEM显微照片可以看出(图3,,7),7),以及甲烷生产与富马酸盐减少的能源产量较低。扫描电子显微镜显示G. metallireducens和M. barkeri附着在生物炭上,但没有相互形成聚集体,这表明两种物种之间的电连接是通过生物炭而不是通过细胞间电子转移(图7)。
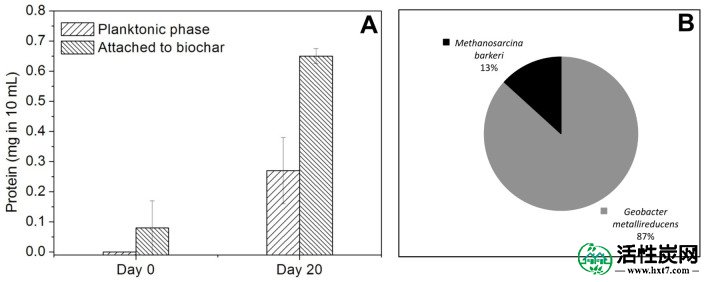
(A)在第0天和第20天在浮游阶段的10mL培养基中的蛋白质并附着于BEC生物炭,和(B)在第20天在G.metallieducens / M中附着于BEC生物炭的细胞的定量PCR分析。巴克里共同文化。误差棒表示一式三份培养物的平均值的标准偏差。
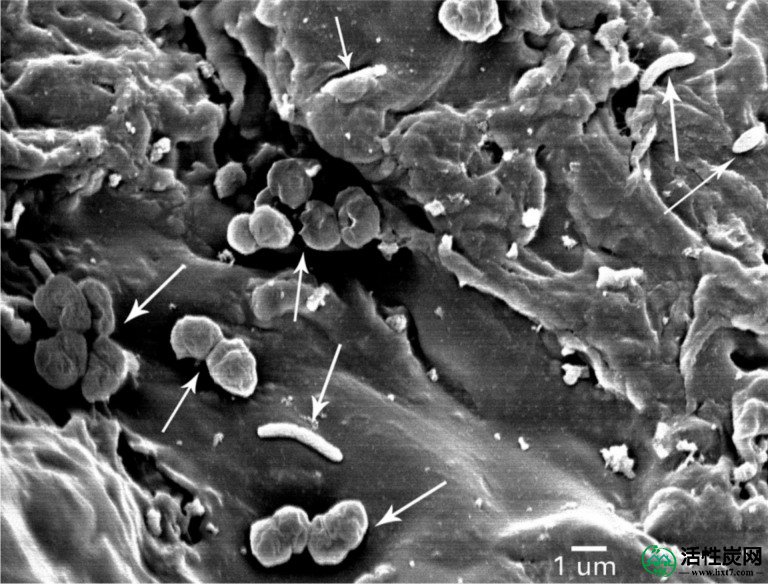
白色箭头指向代表性细胞。
结果表明,生物炭具有足够的导电性,以促进基于DIET的共培养物中的营养不良伴侣之间的直接电子转移。这提供了观察,一些生物炭的修正可以增强土壤的甲烷产生一个可能的解释33或在小规模的沼气池转换有机废物为甲烷34,35。
结果表明,生物炭通过基于传导的机制促进种间电子交换,其中电子通过生物炭从供电子迁移到电子接受细胞。这类似于通过GAC 9提出的种间电子转移的机制,但与电子穿梭物如腐殖质25的细胞外电子交换显着不同。在没有导电材料的情况下,微生物一起生长,需要长的适应时间和多次转移13,以获得与用生物炭或GAC 9观察到的相同的底物消耗速率。这表明细胞需要时间来表达细胞外电子转移所需的细胞组分14。
考虑到生物炭的电导率比GAC的电导率低1000倍,生物炭以与用GAC 9修正的共培养物中观察到的相似的速率和化学计量来促进DIET的能力可能是令人惊讶的。活性炭的更高的导电性很可能是由于增加的表面积和孔隙率和增加的芳构化,该生物炭的在较高温度下转化成活性炭过程中会发生22,23。芳香性是位于不同相邻平面上的芳环之间的电子离域的结果,赋予石墨,木炭或其他有机聚合物24导电性能,并且最近发现甚至可以用于Geobacter物种的菌毛。21。这里评估的生物炭的电导率为比得上 G.硫还原菌毛制剂 20,21,这是足以有效地促进饮食。生物炭的刺激DIET的能力似乎克服了适应时期,细胞需要开始表达高水平所必需的组件的菌毛为主的饮食习惯 13,14,16。通过还原或氧化反应 36掺杂具有增加的芳香性的材料。如果受体微生物减少生物炭的部分并且供体微生物氧化生物炭的部分,则生物炭的部分之间将存在固有的电荷差异,促进电子流动。在活性炭上也注意到了这一点,活性炭接受来自微生物的电子,然后在酸性条件下将电子释放到柠檬酸铁(III)38。
然而,生物炭是一种复杂的材料,可以改变添加了导电性以外的性质的环境。例如,据推测生物炭可以作为减少土壤反硝化过程中N 2 O排放的“ 穿梭 ” 38。而其它的研究表明N个2 ö形成在土壤中是由于非生物过程发生在表面富集生物炭表面带电基团,例如醌类,金属离子或自由基39,40。
我们观察到生物炭在特定的共培养系统中增加甲烷产量,其中合作伙伴能够直接电子转移,改变了目前对生物炭可以减轻甲烷气体排放的理解。考虑到甲烷生产对全球变暖的潜在重大影响以及生物炭在土壤中的持久性,需要进一步研究土壤产甲烷群落如何受生物炭修正以及生物炭对全球碳循环的影响的长期研究。
评估了在生产方式,粒度和表面积方面有所不同的三种松树生物炭(表1)。筛分所有生物炭(孔径3mm),并用透射电子显微镜检查颗粒的大小。其他3种生物炭的布鲁诺尔-埃米特-特勒(BET)表面积分别从N计算2吸附和解吸等温线在77°K使用Quantachrome公司AUTOSORB-1中得到的如先前所描述41。生物炭的电导率通过使用由50微米的非导电间隙分开的两个金电极的两探针电导率测量所确定的,如先前所描述13,20。将生物炭置于两个金电极之间以桥接非导电间隙。使用Keithley 2400源表施加电压。电压从0 V扫描到+0.05 V,步长为0.025 V.对于每个样品,在设置电压后100秒测量电流,以允许间隙中瞬态离子电流的指数衰减并测量稳态电子电流42。我们用Labview数据采集系统(National Instruments,TX,USA)收集数据,并用Igor Pro(Wavemetrics Inc.,OR USA)进行数据分析。
从我们的实验室培养物集合中获得Geobacter metallireducens菌株GS-15(ATCC 53774),Geobacter sulfurreducens菌株PCA(ATCC 51573)和Methanosarcina barkeri型菌株DSM 800(ATCC 43569)。在开始共培养之前,将G. metallireducens维持在含有乙醇(10mM)作为电子供体和柠檬酸Fe(III)(55mM)作为电子受体的培养基中,如前所述17。G.硫还原如先前所述用10mM醋酸作为电子供体和40mM富马酸盐,为电子受体在淡水矿物培养基常规培养17。M. barkeri在具有30mM乙酸盐作为产甲烷基质9的 DSMZ产甲烷培养基120上维持。所有纯培养物和共培养物厌氧培养,在27支用10mL介质毫升压力管的N个80:20缺氧气氛下2:CO 2如前所述13,17。
的共培养物G. metallireducens和G.硫还原如先前所述发起9,17通过引入各种微生物的5%接种物与乙醇(10毫摩尔)作为电子给体和富马酸酯(40毫摩尔)的培养基作为电子受体。孵育温度为30℃。用每种微生物的5%接种物引发G.metalliedunsns和M.barkeri的共培养物到含有20mM乙醇作为电子供体9的 DSMZ产甲烷培养基120中。产甲烷共培养物的孵育在37℃下进行。所有实验均进行三次生物学重复。
为了测试生物炭改良剂的效果,在N 2:CO 2下将0.25g生物炭加入0.5ml合适的共培养基中,并将培养基高压灭菌30分钟。在厌氧条件下加入另外的无菌培养基(9ml),然后接种乙醇和细胞。
生物炭的水提取物是通过在无菌,厌氧条件下在振荡器上将9g培养基中的0.25g生物炭孵育10天(G.metallireducens - G. sulfurreducens共培养物)或20天(G. metallireducens-)来获得的。 M. barkeri共培养物)以复制共培养物暴露于生物炭的时间长度。之后加入乙醇和细胞。
DNA从如先前所述,由一式三份10毫升共培养物附着到生物炭的细胞中提取9。以确定与生物炭修正在共培养物中的细胞的具体丰度,定量PCR使用进行G. metallireducens特异性引物(Gmet_F 5'-TGGCCCACATCTTCATCTC-3',Gmet_R 5'-TGCATGTTTTCATCCACGAT-3'),相对于引物的通用既G. sulfurreducens和G. metallireducens(Geo16S_F 5'-GAGGTACCGTCAAGACCAA-3',Geo16S_R 5'-GCCACACTGGAACTGAGACA-3'),或特异于Methanosarcina物种(MB16S_F 5'-GGGTCTAAAGGGTCCGTAGC-3',MB16S_R 5'GTTCTGGTAAGACGCCTTCG-3'),取决于所测试的共培养物的类型。在进行定量PCR实验之前,引物对验证了引物效率。按照制造商的方案,使用Fast Syber green master mix(ABI)在实时PCR循环仪(ABI-9500)中进行定量PCR。
为了评估细胞与生物炭的附着,在共培养生长结束时(G.metallireducens-G.sulfurreducens循环的第10天和G的第20天)通过扫描电子显微镜研究了附着生物炭的部分。 metallireducens-M.skayeri)。首先将样品用2.5%戊二醛在0.1M磷酸盐缓冲液中于4℃固定12小时,然后在0.1M磷酸盐缓冲液中于4℃洗涤3次,每次10分钟,在乙醇/水混合物中进一步脱水。每次10分钟50%,70%,80%,90%,95%和100%(在100%乙醇中脱水3次),最后在纯六甲基二硅氮烷(Sigma Aldrich,St Louis)中浸泡两次30秒,MO,USA)接着进行10分钟风干43。
用于甲烷和乙醇的气相色谱分析的子样品和乙酸盐,富马酸盐,甲酸盐和琥珀酸盐的高效液相色谱分析取出并如前所述进行处理32。为了在共培养温育结束时进一步支持生物炭附着到生物炭上,通过在0.5N NaOH中裂解生物炭将液体部分与生物炭分离,并用无菌玻璃珠打浆30秒以确保细胞破裂。使用二辛可宁酸方法44以牛血清白蛋白(BSA)作为蛋白质标准测定培养上清液和生物炭级分中的细胞蛋白质。