发布日期:2018-11-06 15:18 来源:活性炭网 作者:活性炭网 浏览数:
抽象 通过FeCl 3 改性活性炭(AC) 。 进行批量实验以评估磺胺二甲嘧啶吸附到原始和改性AC上的平衡,动力学和热力学特征。 结果显示Fe 3+ 处理改变了表面积,孔隙体积和表面zeta电位,
磺胺类药物是新兴的污染物,主要用于治疗各种细菌感染引起的疾病; 它们被广泛用于畜牧业和水产养殖业1,并引起了广泛的研究关注。大多数磺胺类药物通过动物粪便和尿液以原始药物或代谢物的形式释放到环境中,这些药物或代谢物可能在环境中长期存在,成为潜在的环境污染风险2。研究表明,这些抗生素的残留物可以通过农场径流和城市污水处理厂3 - 6进入土壤,地表水,地下水甚至饮用水。
进入环境后,磺胺类药物会缓慢降解。抗生素污染物的残留浓度是仅在环境水中纳克/ L-微克/升,但它积累在人体中,并将最终危害人体健康当人类暴露于低浓度的时间长7,8。此外,过量的抗生素和代谢物可以诱导微生物抗性基因,即使它们在环境中的暴露限于痕量水平,也可能对生态环境和人类健康造成潜在风险。此外,磺胺二甲嘧啶可在较低的暴露水平下引起急性或慢性中毒。
传统的污水处理技术只能去除废水中的一些抗生素9 - 11。这促使研究人员开发出简单,高效的新技术,有效去除废水中的磺胺类药物。活性炭由于其大的比表面积和复杂的孔结构,可以有效地去除色度,气味和一些无机化合物和大多数有机污染物12。然而,其在实际应用中的使用受到其较低的吸附效率和成本限制的限制。金属离子改性13改性活性炭的常用方法是简单,廉价,可显着提高活性炭的吸附性能。然而,磺胺类药物在活性炭上的吸附机理目前尚不清楚,目前对磺胺类药物的吸附能力与其理化性质之间的相关关系知之甚少。
在这项研究中,采用Fe 3+来改性活性炭。批量吸附实验用于探索吸附机理。通过吸附动力学,吸附热力学和吸附等温线研究了磺胺二甲嘧啶对原始和改性活性炭的吸附特性,为废水中药物和个人护理产品(PPCPs)的去除提供了科学依据。
磺胺二甲嘧啶(SMX≥99.0%)用作吸附物化合物,并且来自德国的Ehrenstorfer博士。磺胺二甲嘧啶的化学结构和物理化学性质列于表 1。使用甲醇和甲酸作为色谱试剂,并使用其他化学品作为分析试剂。研究中使用的水来自杭州娃哈哈集团有限公司。
磺胺二甲嘧啶的物理化学性质。
| 复合 | CAS | 化学式 | M(g·mol -1) | 熔点(°C) | pK a | 溶解度(毫克/升) | logK ow |
|---|---|---|---|---|---|---|---|
| SMX | 57-68-1 | C 12 H 14 N 4 O 2 S. | 278.33 | 176 | 2.28 | 1500 | 0.89 |
| 7.42 |
活性炭(AC)购自江苏的活性炭工厂。将其通过100目筛筛分以获得均匀粉末,擦洗5至6次,然后在105℃下干燥8小时。
使用配备有聚四氟乙烯衬里螺旋盖的250-mL锥形瓶,将总共10g AC与100mL0.75mol·L -1 FeCl 3溶液混合。将其在恒温振荡器中以恒定的搅拌速度(180rpm)摇动24小时。离心后用液体与固体分离,提取固体,用0.45μm纤维素酯膜过滤器过滤,用去离子水清洗5-6次。然后,将其在105℃下干燥8小时并研磨。最后,通过100目筛获得改性活性炭(MAC)。
根据OECD指南106 14,在不同的吸附时间,初始吸附物浓度,pH和温度下进行磺胺二甲嘧啶的批量吸附实验。用于分析物检测的校准曲线(0.1-100 mg·L -1浓度)呈现良好的线性(R 2 > 0.999)。将没有固体颗粒的SMX溶液样品保持在与空白样品相同的条件下。空白样品中的天然SMX降解率小于1%并被忽略。此外,基于三次测量,UPLC分析的方差系数小于5%。
使用配有聚四氟乙烯衬里圆顶帽的30-mL玻璃瓶,将总共0.15g AC和MAC与25mL不同的初始SMX浓度(10-100mg·L -1)混合。将具有0.01mol·L -1 CaCl 2的SMX溶液在恒定的搅拌速度(220rpm)下在恒温振荡器中在未调节的pH下摇动24小时。使用5000rpm离心SMX溶液15分钟以将液体与固体分离。最后,提取上清液并用0.22μmPTFE微孔膜过滤。
通过将0.15g样品和20mL 100mg·L -1 SMX溶液添加至30mL玻璃瓶中来进行AC和MAC的吸附动力学研究。然后,在25℃下以恒定的搅拌速度(220rpm)摇动所有玻璃小瓶。分别在5,10,20,40,60,90,120,180,360,540,720,1080,1440,2160和2880分钟获得样品。
在25℃的30mL玻璃小瓶中将总共0.15g AC和MAC加入到25mL SMX溶液中,在恒温振荡器中以恒定的搅拌速度(220rpm)振荡24小时。用0.01mol·L -1 NaOH和HCl 预先调节含有浓度为100mg·L -1的磺胺二甲嘧啶的0.01mol·L -1 CaCl 2水溶液,pH值在3~10之间。
使用4.6×250mm Athena C18-WP柱和UV检测器通过HPLC(Agilent Technologies 1200系列)分析上清液中的磺胺二甲嘧啶浓度。磺胺二甲嘧啶定量的流动相为0.1%甲酸/甲醇(65%:35%,v:v),UV检测器的波长为265nm。在使用前,通过微孔有机膜(0.22μm)和微孔排水膜(0.22μm)过滤甲醇和0.1%甲酸。流速为0.8mL / min,柱温为30℃。注射体积为20μL。
使用比表面积分析仪(BET,SSA-4000,北京)测定原始和改性活性炭样品的比表面积,孔体积和孔径。使用SEM-EDS(JSM-6700F,日本)和TEM(JEM-2100,日本)分别进行AC和MAC的表面形态,孔结构和元素分析。使用拉曼光谱(Renishaw-RM2000)分析吸附剂的石墨化水平。XRD(Bruker D8)用于AC和MAC的晶体形式。
作者同意数据可用。
原始和改性活性炭的化学结构和物理化学性质列于表 2中。经Fe 3+改性后,活性炭的表面积,总孔容,微孔体积和中孔体积均有一定程度的增加,可为磺胺二甲嘧啶提供更多的吸附位点。由于改性,活性炭的微孔结构可能被破坏,从而产生更大的比表面积。Fe 3+主要在活化过程中沉积在介孔中,扩大了孔径并进入微孔。将由金属盐释放的氧化气体引入微孔中并与微孔碳壁15反应。
原始和改性活性炭的化学和物理性质。
| 物料 | BET m 2 / g | 平均孔径nm | 总孔体积cm 3 / g | 微孔体积cm 3 / g | 中孔体积cm 3 / g |
|---|---|---|---|---|---|
| AC | 70.96 | 2.90 | 0.1029 | 0.0310 | 0.0719 |
| 苹果电脑 | 166.23 | 4.76 | 0.192539 | 0.072302 | 0.1202 |
AC和MAC的SEM图像显示在图 1(a)和(b)中。AC形态表明具有规则孔结构的光滑表面。与天然活性炭相比,MAC表面看起来粗糙且不规则。规则的孔隙结构被破坏,孔隙率增加。这可能是由于在活性炭的内部孔中引入Fe 3+,导致碳壁的氧化和孔径的增加。粗糙表面结构和多孔特性有利于加速磺胺二甲嘧啶在活性炭中的扩散。AC和MAC的TEM图像如图1(c)和(d)所示。 。这些照片表明AC是无定形的。与AC相比,MAC表现出许多孔隙和透明点,进一步表明表面积增加。AC和MAC的EDS图像如图 1(e)和(f)所示。与AC相比,MAC的元素O和Fe含量显着增加,C含量降低,表明Fe 3+负载在活性炭上。此外,进一步证明表面含氧官能团增加,这有利于磺胺二甲嘧啶的吸附。AC和MAC的XRD图如图 1(g)和(h)所示。并且没有AC和MAC的明显特征峰,表明它们是无定形的。这与TEM照片的结果一致。

两种吸附剂的代表性SEM,TEM和EDS图像。(a)AC的SEM(比例尺为2μm),(b)AC的TEM(比例尺为100nm),(c)AC的EDS,(d)MAC的SEM(比例尺为2μm),(e)MAC的TEM(比例尺为100nm),(f)MAC的EDS,(g)AC的XRD,(h)MAC的XRD。
由于表面化学性质的变化和孔结构的改变,磺酰胺对改性活性炭的吸附能力发生了很大的变化。表面化学性质的变化可以通过分析原始和改性活性炭上的官能团来确定。
原始活性炭和Fe 3+修饰的FT-IR光谱如图2所示 。原始和改性活性炭在3400cm -1处存在吸收峰,这是由于与氢键,酚羟基和NH伸缩振动相关的-OH振动引起的。-OH峰的强度显着增强,表明通过改性增加-OH的数量。与AC相比,MAC在2850cm -1处具有显着的吸附峰。这可以对应于OH伸缩振动。该波段在1630 cm -1处可能是NH变形振动,酚羟基,C = C或C = O伸缩振动。很明显,吸收光谱表现出红移。2120cm -1和1010cm -1处的条带可分别分配给NH和CO伸缩振动。665cm -1处的带可以指定为FeOOH伸缩振动,这是由Fe 3+改性的活性炭的典型组。这些基团可以进一步提高活性炭的吸附能力。
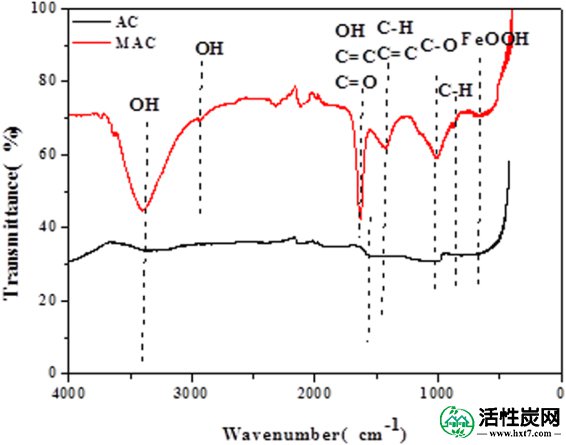
原始和改性活性炭的FT-IR光谱。
原始和改性活性炭的FT-IR光谱显示出相似的吸附峰,表明原始和改性活性炭具有相似的化学性质。然而,MAC的吸光度显着降低,表明活性炭的有机结构被破坏,并且在改性过程中酸性基团含量增加。此外,改性活性炭增加了磺胺二甲嘧啶吸附活性位点的数量。
在碳材料的拉曼光谱中观察到两个峰(图 3),第一个峰接近1595 cm -1(G峰),这是石墨的特征散射峰,第二个峰在1350 cm -1处( D峰),这是由晶格缺陷,无序排列和石墨16的低对称碳结构引起的。可以使用n D峰和G峰的强度比来评估石墨化程度:
其中R是碳材料的石墨化程度,I D是1360cm -1处D峰的强度,I G是1580cm -1处G峰的强度。较小的R值对应于较高程度的石墨化17。原始和改性活性炭的值分别为1.11和1.06,表明Fe 3+修饰的活性炭的石墨化程度较高,并且在一定程度上,它可以促进磺胺二甲嘧啶的吸附能力。
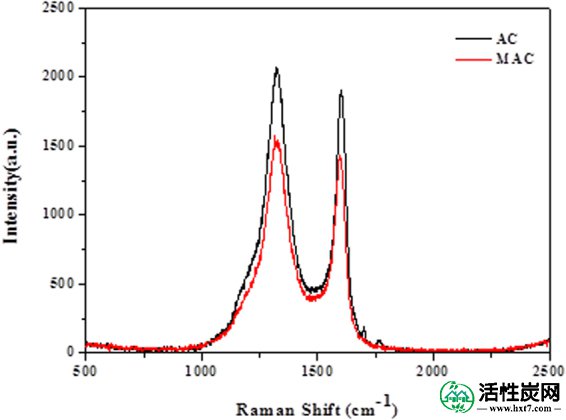
原始和改性活性炭的拉曼光谱。
pH值对磺胺二甲嘧啶的吸附有很大影响。溶液的pH控制吸附剂上的表面官能团的解离度,这可以改变活性炭18的表面电位。活性炭上的化学官能团取决于溶液的pH值。当pH值达到一定范围时,羟基和羧基等官能团将水解并影响活性炭上的表面电荷。溶液的pH值也可以影响磺胺二甲嘧啶的溶解度和形式。因此,pH会影响吸附过程。
磺胺二甲嘧啶存在的形式在不同的pH值下是不同的,其解离常数是2.28(pK a,1)和7.42(pK a,2)。根据pH值,磺胺二甲嘧啶可呈现阳离子,中性或阴离子形式18。在pK a,1和pK a,2之间的pH值下实现了高吸附容量其中磺胺二甲嘧啶几乎完全以中性形式存在,表明与阳离子或阴离子形式相比,中性磺胺二甲嘧啶很容易吸附在活性炭上。随着pH值的降低,中性磺胺二甲嘧啶的比例下降,阴离子磺胺二甲嘧啶的比例逐渐增加。活性炭表面存在大量疏水性和亲水性基团,磺胺二甲嘧啶可以通过这些基团的疏水作用吸附。磺胺二甲嘧啶在高于7.42的pH下去质子化,然后在溶液中作为负离子存在。由于磺胺二甲嘧啶与活性炭负电荷之间的静电排斥,磺胺二甲嘧啶的吸附减少。
对于AC值和MAC,磺胺二甲嘧啶的吸附首先增加然后降低,pH值在3到10之间(图 4)。当pH低于5.0时,吸附增加。这可能是由于竞争性吸附与H +共存,导致吸附较少。随着pH值的增加,竞争吸附减少,磺胺二甲嘧啶吸附增加。由于氨基磺酸盐对氨基磺酸盐的去质子化弱,对于pH值在5.0和7.0之间,磺胺二甲嘧啶几乎完全作为质子化的中性分子存在。苯的电子可被中性磺胺二甲嘧啶的氨基和磺酰基吸引,使磺胺二甲嘧啶成为π电子受体,从而实现更大的吸附。
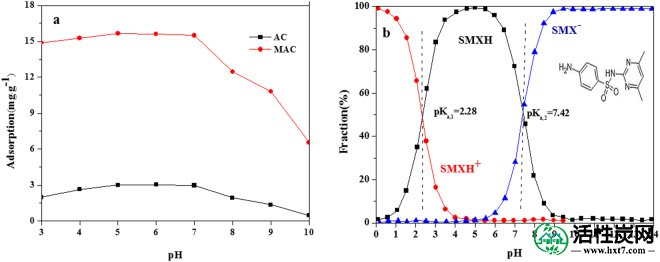
pH对去除磺胺二甲嘧啶的影响(a)SMX的吸附,(b)阳离子(菱形),中性(正方形),阴离子(三角形)的摩尔分数。
磺胺二甲嘧啶在MAC上的吸附高于AC。这可能是由于Fe离子和磺胺二甲嘧啶之间的协调作用。在高于8.0的pH下,阴离子磺胺二甲嘧啶的比例将增加,增加静电排斥并抑制中性磺胺二甲嘧啶与活性炭之间的疏水相互作用。另外,Fe在碱性条件下主要处于改性活性炭表面的离子状态,导致配位能力弱。同时,改性活性炭表面的羧酸变为氨基,其中与氨基的静电排斥增加,吸附能力降低。
AC和MAC在25℃下的吸附等温线如图5所示 。当SMX的平衡浓度低时,磺胺二甲嘧啶的吸附迅速增加。随着SMX平衡浓度的增加,吸附速率逐渐降低,然后达到饱和状态。
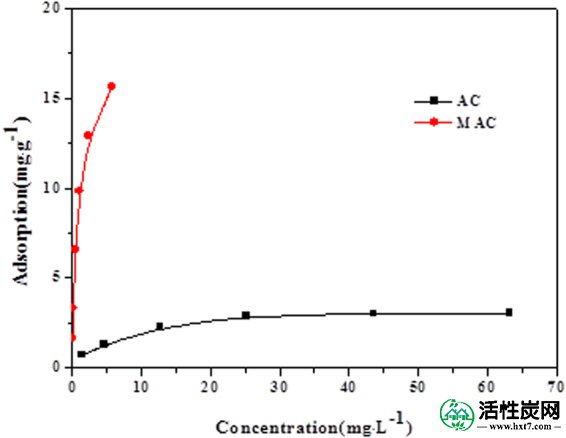
不同温度下SMX在AC和MAC上的吸附等温线。
未改性活性炭的吸附量低于图 5,最大吸附量在25℃下为3.0713mg / g。然而,用Fe 3+改性的活性炭上的吸附量显着提高,并且在25℃下的最大吸附值为17.2414mg / g,显示出增加5.6倍。磺胺类是极性有机化合物,通过Fe 3+改性将大量官能团引入活性炭表面,增加了活性炭的表面极性。许多羟基和羧基存在于改性活性炭的表面上,其可与磺胺二甲嘧啶的碱性氨基化物反应形成离子键。Fe 3+ 改性活性炭表面的离子可以与氨基酸配位,提高磺胺二甲嘧啶的吸附能力。
使用三种不同的等温线模型来拟合吸附平衡等温线。Langmuir,Freundlich和Temkin的方程表示如下:
Langmuir型号:
Freundlich型号:
Temkin型号:
其中q e(mg / g)是每单位质量吸附剂吸附的SMX的吸附量; C e(mg / L)是SMX的吸附平衡浓度; q max(mg / g)是取决于吸附剂性质的最大吸附容量; K L(L / mg)是与吸附键能相关的Langmuir吸附亲和常数; K F和1 / n分别代表吸附容量和吸附强度的Freundlich吸附常数; 1 / n表示非线性吸附程度和吸附机理的差异,通常认为当n> 1时发生优先吸附; 和K T. (L / kg)是平衡结合能的Temkin吸附常数。
Langmuir等温线可以通过分离因子(R L)表示,并使用以下等式计算:
其中C 0(mg / L)是SMX的初始浓度。几种类型的吸附等温线可以用R L表征。当R L = 0时,吸附剂上的吸附过程是不可逆的。当R L值介于0和1之间时,吸附过程是有利的,这是最佳的吸附等温线。线性吸附表示为R L = 1.否则,难以在吸附剂上发生吸附。
表 3显示了符合磺胺二甲嘧啶的等温吸附模型的数据。使用Langmuir和Temkin模型获得的R 2值大于Freundlich模型的R 2值,表明这些模型可以更好地适应磺胺二甲嘧啶在原始和改性活性炭上的吸附过程。然而,与Freundlich模型相比,Langmuir和Temkin模型能很好地拟合吸附过程,表明磺胺二甲嘧啶的吸附主要受单层吸附和表面吸附的影响。在本研究中,R L.值均在0和1之间,表明吸附是有利的。随着磺胺二甲嘧啶和改性活性炭之间的相互作用增加,吸附能量线性下降19。
不同温度下磺胺二甲嘧啶在AC和MAC上的吸附等温线参数。
| 朗缪尔 | 符合Freundlich | 特姆金 | ||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| q 最大 | K L | R L. | R 2 | K F | 1 / n的 | R 2 | K T. | R 2 | ||
| (mg·g-1) | (L·mg-1) | (mg·g -1)(L·mg -1)1 / n | ||||||||
| AC | 298 K. | 3.0713 | 0.2169 | 0.0461 | 0.9764 | 0.6896 | 0.3968 | 0.9499 | 0.6738 | 0.9668 |
| 苹果电脑 | 298 K. | 17.2414 | 1.6910 | 0.0059 | 0.9776 | 8.2604 | 0.4824 | 0.9420 | 3.1358 | 0.9960 |
Freundlich常数1 / n低于0.5,表明初步吸附过程容易发生。另外,n> 1,表明磺胺二甲嘧啶的吸附优先于原始和改性的活性炭。随着磺胺二甲嘧啶浓度的增加,吸附过程变得困难。Langmuir系数R L值均在0和1之间,表明磺胺二甲嘧啶的吸附也是优先的20,进一步证明Langmuir模型能很好地适应吸附过程。
以前对磺胺类药物的研究主要集中在土壤,腐殖质,有机物和粘土矿物上。表4列出了近年来研究的材料吸附的对比分析 。磺胺二甲嘧啶对Fe 3+修饰的活性炭的吸附能力高于其他吸附剂。Fe 3+修饰的活性炭具有简单,经济,环保的优点,其成本低,制备条件温和,磺酰胺类抗生素的去除效率高,因此在实际应用中引起了越来越多的关注。
吸附动力学主要用于研究吸附速率随时间的变化。原始和改性活性炭在25℃下的吸附动力学曲线显示出相似的吸附特征(图 6并且可以在24小时内达到平衡。吸附量随时间增加; 两种物质的吸附过程首先处于快速反应阶段(0-2h),吸附量分别为平衡吸附量的76.2%和86.9%(3.04 mg / g和15.64 mg / g)。吸附容量随时间呈线性关系,然后当原始和改性活性炭的表面活性位点被占据时减慢。磺胺二甲嘧啶的吸附过程可分为两个过程 - 快速吸附阶段和慢吸附阶段。在快速反应阶段,活性炭或磺胺二甲嘧啶在水中的分散性很高,磺胺二甲嘧啶迅速扩散到活性炭的活性部位。然后,磺胺二甲嘧啶扩散到活性炭的内部孔隙中,在慢反应阶段随时间增加传质阻力。吸附速率取决于吸附剂的性质和溶液的pH值,并随时间减慢达到平衡。
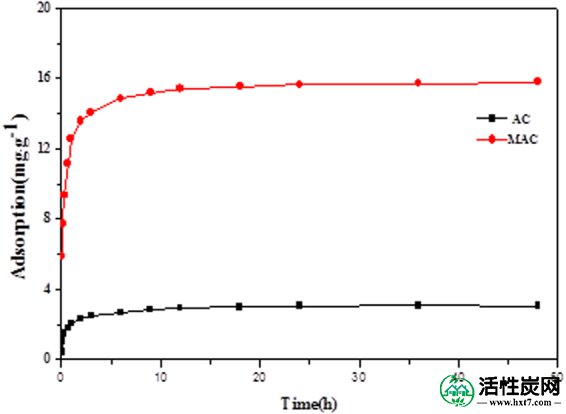
磺胺二甲嘧啶在AC和MAC上的吸附动力学。
为了探索吸附动力学的特征,目前的研究使用三种动力学模型来拟合磺胺二甲嘧啶吸附在原始和改性活性炭上的过程。伪一阶,伪二阶和内扩散方程21,22被表示为如下:
伪一阶模型:
伪二阶模型:
粒内扩散模型:
其中q e和q t(mg / g)分别是在平衡和时间t(h)时每单位质量吸附剂吸附的SMX的量; k 1和k 2(g / mg·min -1)分别是拟一级和伪二级吸附速率常数; k 3(mg /(g·min 1/2))是与粒子扩散系数D有关的粒子内扩散模型的吸附速率常数,
表 5显示了符合传质模型的数据。拟二级模型对原始和改性活性炭的吸附过程拟合较好,相关系数R 2 > 0.999表明吸附速率与污染物浓度的平方成正比。化学反应可能是吸附过程的一个重要限制因素,它也可能受吸附剂和吸附质之间的相互作用和交换电子的影响23。拟一级动力学方程更适合描述初始阶段的动力学,在应用过程中有一定的局限性,而伪二阶模型动力学方程包含吸附过程的完整三个阶段 - 膜扩散,表面吸附和内部扩散 - 可以更适合这种吸附过程24。
磺胺二甲嘧啶吸附动力学模型在AC和MAC上的拟合参数。
| 伪一阶模型 | 伪二阶模型 | 粒内扩散模型 | ||||||
|---|---|---|---|---|---|---|---|---|
| k 1 | q e | R 2 | k 2 | q e | R 2 | K 3 | R 2 | |
| min -1 | 毫克/克 | g / mg·min -1 | 毫克/克 | mg / g·min 0.5 | ||||
| AC | 0.4732 | 3.168 | 0.9672 | 1.7244 | 3.098 | 0.9998 | 0.3128 | 0.6659 |
| 苹果电脑 | 0.1363 | 14.82 | 0.9688 | 3.3743 | 15.85 | 1 | 1.1747 | 0.6062 |
为了进一步确定磺胺二甲嘧啶吸附过程的扩散机理,采用颗粒内扩散模型确定了吸附过程中吸附速率的主要控制因素。结果表示如下(图 7)。
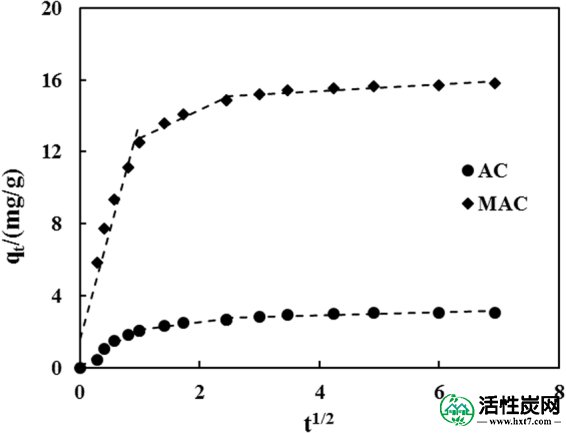
磺胺二甲嘧啶在活性炭上吸附的颗粒内扩散结果。
磺胺二甲嘧啶在原始和改性活性炭上的吸附和扩散过程可分三个阶段描述,如图7所示。 。由于在第一阶段吸附在活性炭表面上,吸附速率最初很高。然后,发生快速的颗粒内扩散过程,其中磺胺二甲嘧啶逐渐吸附在活性炭上,并且吸附速率常数逐渐降低。在第三阶段,边界层和传质阻力的影响增加,导致颗粒内扩散减慢。所有三个阶段的拟合方程都没有通过坐标的原点,这表明颗粒内扩散不是控制吸附速率的唯一步骤。因此,吸附过程也受膜扩散和表面吸附的影响。
在不同温度下磺胺二甲嘧啶在原始和改性活性炭上的吸附结果如图8所示 。随着温度的升高,磺胺二甲嘧啶在两个活性炭表面的吸附量逐渐减少,表明高温对吸附反应不利。因此,这表明原始和改性活性炭的吸附过程是放热的,并且磺胺二甲嘧啶的吸附在较低温度下更有利。
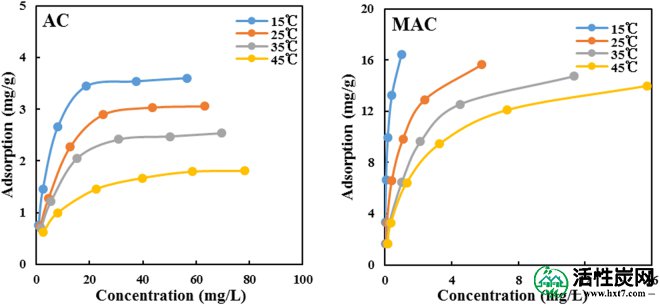
SMX在不同温度条件下的吸附量。
温度对吸附的影响可以用热力学参数表示。吸附自由能的变化是反映吸附剂吸附特性的重要参数。当自由能变化小于40 KJ·mol -1时,发生物理吸附; 否则,存在化学吸附(国家环境保护总局有毒化学品管理办公室,1992)。可以使用热力学方程和吸附常数计算这些值,结果如表6所示 。
磺胺二甲嘧啶在AC和MAC上吸附的热力学参数。
| 吸附剂 | TK | R L. | ΔGkJ·mol -1 | ΔHkJ·mol -1 | ΔSJ·K -1 ·mol -1 |
|---|---|---|---|---|---|
| AC | 288 | 0.0350 | -20.01 | -17.03 | 10.38 |
| 298 | 0.0461 | -20.14 | |||
| 308 | 0.0476 | -20.24 | |||
| 318 | 0.0511 | -20.32 | |||
| 苹果电脑 | 288 | 0.0010 | -23.49 | -8.88 | 50.99 |
| 298 | 0.0059 | -24.17 | |||
| 308 | 0.0107 | -24.65 | |||
| 318 | 0.0115 | -25.02 |
温度对吸附的影响可以用热特性参数表示:
其中ΔG(kJ / mol)是标准吉布斯自由能,ΔG<0,表明反应是自发的; Δ 小号(J /(K·摩尔))和Δ ħ(千焦/摩尔)分别是熵和焓的变化; K t和R(8.314 J /(mol·K))分别是温度T(K)和气体常数下的Langmuir常数。Δ 小号 > 0表明病症的在固-液界面的程度增加。Δ ħ > 0表示吸附剂的吸附过程是吸热的; 否则,它是放热的。
标准吉布斯自由能(ΔG)在实验温度下为负(表 6),表明磺胺二甲嘧啶在原始和改性活性炭上的吸附过程在288K和318K之间的温度下是自发的,并且|ΔG|。<40千焦·摩尔-1,这表明在活性炭上的吸附磺胺二甲嘧啶的主要原因是氢键,疏水,π-π共轭,以及协调的相互作用的物理吸附型的25。ΔH<0表明吸附过程是放热的,较高的温度不利于磺胺二甲嘧啶的吸附。R L与温度之间的关系如表 6所示。所有R L值低于1,表明吸附过程是自发的和有利的。随着温度的升高,R L增加,表明温度的降低可以促进吸附反应。ΔS> 0表明在吸附过程中无序程度增加。有许多水分子从活性炭中解吸,导致活性炭表面上暴露的吸附位点数量增加。
改性活性炭的表面显示出许多孔隙和透明点,并且大量含氧官能团被改性,导致磺胺二甲嘧啶吸附机理发生变化。根据本研究的相关研究结果,磺胺二甲嘧啶在活性炭表面的吸附机理总结如下(图 9):
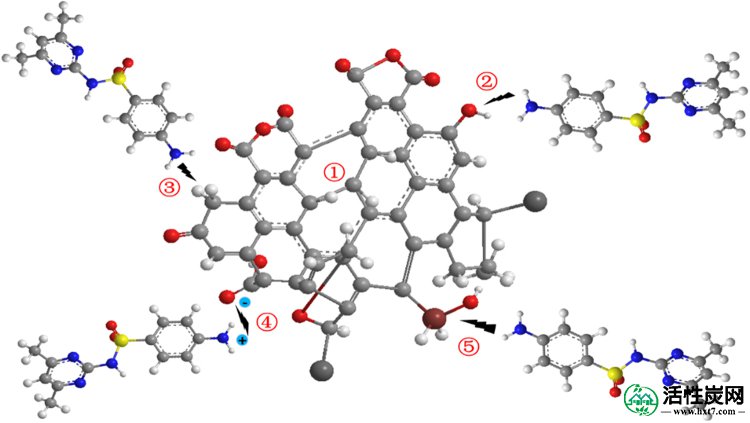
磺胺二甲嘧啶和MAC之间合理相互作用的示意图。1)微孔捕获2)氢键相互作用3)π-πEDA相互作用4)静电相互作用5)配位相互作用。
磺胺二甲嘧啶的pH约为5.0-7.0,其中磺胺二甲嘧啶上的氨基被质子化。苯环的电子可以通过中性磺胺二甲嘧啶的amidogen和磺酰基,这使得它的π电子受体被吸引27,28。拉曼光谱表明,改性活性炭的石墨化程度较高,其中MAC的石墨结构可以在SMX和MAC 29之间产生额外的π-πEDA相互作用。
此外,磺胺二甲嘧啶对MAC的吸附机制也受静电相互作用30和配位相互作用的影响31。磺胺二甲嘧啶分子可以在不同的pH值下水解,并且可以在水溶液中呈现几种形式。然而,在pH <5.0时,酸性氧官能团的负电荷表明与磺胺二甲嘧啶的阳离子中心(-NH 3 +)存在强烈的静电相互作用。磺胺二甲嘧啶的分子结构显示碱性-NH 2和-OH基团,其可以与金属离子配位或产生氢键。许多研究证明了重金属离子与-NH 2和-OH 之间的配位相互作用32, 33。因此,磺胺二甲嘧啶极易被固体颗粒吸附并从水溶液中除去。通常,磺酰胺显示出良好的水溶性,并且在中性pH条件下主要以负离子和中性粒子的形式存在。因此,磺胺二甲嘧啶与改性活性炭之间的静电相互作用非常弱。因此,磺胺二甲嘧啶对改性活性炭的吸附机理主要是微孔捕获,氢键相互作用和π-πEDA相互作用。在碱性条件下也存在静电相互作用和配位相互作用。
经Fe 3+改性后,活性炭的表面积,总孔容,微孔体积和中孔体积均有所增加。活性炭表面含氧官能团的数量也增加,可以大大提高吸附能力。Freundlich等温线,Langmuir等温线和Temkin等温线可以为SMX吸附数据提供令人满意的拟合。在MAC上去除SMX显着增加,并且在25℃下磺胺二甲嘧啶在MAC上的最大吸附量为17.2414mg / g。然而,吸附平衡时间几乎不变。磺胺二甲嘧啶在原始和改性活性炭上的吸附动力学分为快速和慢速吸附阶段,SMX吸附在12 h内快速完成。拟二级动力学模型很好地拟合了SMX吸附实验数据。颗粒内扩散不是吸附的唯一速率控制步骤。吸附过程也受膜扩散和内部扩散的影响。吸附热力学参数表明原始和改性活性炭的吸附过程是自发的和放热的。温度的降低促进了吸附反应。pH值对SMX的吸附具有显着影响。当pH值在3-10之间时,磺胺二甲嘧啶的吸附量先增加后减少。微孔捕获,静电相互作用,氢键相互作用,π-πEDA相互作用和配位相互作用是吸附的可能机制。温度的降低促进了吸附反应。pH值对SMX的吸附具有显着影响。当pH值在3-10之间时,磺胺二甲嘧啶的吸附量先增加后减少。微孔捕获,静电相互作用,氢键相互作用,π-πEDA相互作用和配位相互作用是吸附的可能机制。温度的降低促进了吸附反应。pH值对SMX的吸附具有显着影响。当pH值在3-10之间时,磺胺二甲嘧啶的吸附量先增加后减少。微孔捕获,静电相互作用,氢键相互作用,π-πEDA相互作用和配位相互作用是吸附的可能机制。