发布日期:2018-11-07 11:55 来源:活性炭网 作者:活性炭网 浏览数:
抽象 活性炭(AC)是一种越来越有吸引力的补救方法,用于在全球污染场地中隔离二恶英。 然而,AC降低哺乳动物和居住的肠道微生物群中二恶英的生物利用度的可能性受到较少关注。
多氯二苯并- p -dioxins和呋喃,或简单地二恶英,是一组在环境中是普遍的持久性有机污染物(费拉里奥等人,2000。 ; Gadomski等人,2004。 )。二恶英暴露,通常来自鱼类或乳制品等食物,部分是河流沉积物和洪泛区持续存在和积累的结果,需要不断进行补救(Yamashita等,2000 ; Ghosh等,2011)。与用墙壁和封盖进行疏浚或隔离相比,替代修复方法(如原位活性炭(AC)吸附剂修正)是一种经济上可行的控制机制(Bridges et al.2010 ; EPA 2013))。因此,AC最近已在全世界的多个污染场所实施(Patmont等人,2015)。尽管AC越来越多地使用并证明了AC降低水生无脊椎动物和蚯蚓中二恶英的生物利用度的可能性(Fagervold等人,2010 ; Josefsson等人,2012)对哺乳动物的影响,但其居住的肠道微生物群受到的关注较少。
This question was addressed, in part, in a recent study that examined the availability of 2,3,7,8-tetrachlorodibenzo-p-dioxin (TCDD) amended to AC (AC-TCDD) in a murine model (Boyd et al. 2017). Classic markers of TCDD-induced toxicity were measured including modulation of the IgM antibody-forming cell (AFC) and the dioxin-inducible cytochrome P450 family cyp1a1 messenger RNA (mRNA) gene expression. Results from that study supported the use of AC to eliminate bioavailability of dioxins in mammals in that TCDD-induced host responses were observed only when administered with corn oil (CO-TCDD). Responses were not observed with equivalent TCDD doses administered with AC.
本研究的目的是(1)检测TCDD在小鼠模型中共生的关键肠道上与AC(AC-TCDD)隔离的生物利用度,以及(2)表征AC对肠道微生物群的影响。这是一个重要的问题,因为肠道微生物群在宿主健康和免疫能力中起着至关重要的作用(Littman和Pamer 2011 ; Honda和Littman 2016)。先前的研究已观察到的肠道共生体,包括TCDD诱导的生态失调暂定 Savagella也称为分段丝状菌(SFB),厚壁菌门,和肠杆菌科(Bhaduri 2015 ; Lefever等人2016。 ; Stedtfeld等人2017。,分段丝状细菌对暴露于TCDD的生殖小鼠的转录组学反应的调节作用,提交)。我们小组和其他人进行的实验表明,肠道共生反应是TCDD诱导宿主毒性的结果,部分通过芳烃受体(AhR)介导,而不是TCDD对细菌的直接影响(Lefever等。2016 ; Stedtfeld等人2017年。)。鉴于最近证明AC-TCDD对小鼠标志性反应的生物利用度有限(Boyd等人,2017),我们假设关键肠道共生体的反应也会减弱。为了检验这一假设,检查了SFB的转录组学反应,之前已经证明它对TCDD诱导的毒性有反应(Bhaduri 2015 ; Stedtfeld等。2017)和其他AhR配体(Zhang et al.2015 )。
第二个问题是检查食品级AC对肠道微生物组的影响。除了通过摄入进入食物链的潜力外,AC还被用于从结肠中去除残留的抗生素水平(Khoder等人,2010),或作为食品添加剂以降低动物饲料中污染物的生物利用度(Avantaggiato等,2004) - 畜牧业中抗生素的潜在替代品(Chu等,2013)。AC也被用作意外剂量有毒物质或过量的紧急处理(Holt和Holz 1963)。它越来越多地用作肠道疾病和排毒的补救措施或补充剂。然而,AC干扰肠道微生物组和随后宿主健康的可能性尚未得到很好的记录。这里通过16S核糖体RNA(rRNA)基因测序检查,使用从暴露于AC-TCDD的小鼠的回肠组织中提取的DNA。
5至8周龄的无病原体雌性B6C3F1小鼠购自Charles River Breeding Laboratories(Portage,MI,USA)并如前所述进行处理(Boyd等人,2017)。简而言之,将45只小鼠随机分开,每笼5只,分成9个独立的笼子,每个实验组一个。实验设计(图S1)包括通过口服强饲法给予小鼠,其中玉米油载体(CO)具有0,0.1,1.0和10μg/ kg TCDD,并且小鼠通过口服强饲法给予0,0.1,1.0的AC载体,和10μg/ kg TCDD。还使用了没有口服暴露的幼稚组(n = 5)。将五只小鼠置于每组中用于复制。食品级WPC椰子AC(Calgon Carbon Corp)如前所述用TCDD表征和吸附(Boyd等人。2017)。简而言之,对于AC-TCDD,156.25 mg AC通过初湿含湿法加载TCDD(Boyd等人2011 ; Kaplan等人2011)并且通过使用热解气相色谱分析确认的质谱法在给药之前悬浮在5ml去离子水中。通过口服管饲法每天一次给药小鼠200μl,连续4天,每天产生6.25mg AC-TCDD。在用TCDD第四次和最后一次暴露后3天(实验7天),处死小鼠并收集组织用于分析。在所有治疗期间,小鼠随意获取水和食物。整个实验被复制并包括三只幼稚小鼠作为无治疗对照。所有动物均按照密歇根州立大学批准的动物使用方案接受人道护理。
从所有小鼠的回肠中提取RNA以评估SFB响应TCDD的转录组反应。在处死时,对于所有动物,从盲肠的近端移除0.25cm的段,并用于随后的分析。将肠组织样品加入RNA / DNA稳定剂中并在-80℃下储存直至进一步使用。使用含有Trizol的PureLink RNA Mini Kit(12183018A,Ambion / Thermo Fisher Scientific,Waltham,MA)从回肠组织和内容物中提取和纯化RNA。使用包括DNA酶I(Invitrogen / Thermo Fisher Scientific,Waltham,MA)和Turbo DNAse I试剂盒(Life Technologies / Thermo Fisher Scientific,Waltham,MA)的两步法进一步处理RNA以除去DNA。提取后,使用Qubit(Life Technologies)定量分离的RNA,并使用Nanodrop ND-1000UV-Vis分光光度计(Nanodrop Products,Wilmington,DE)评估纯度。使用High-Capacity cDNA Reverse Transcription Kit(Thermo Fisher Scientific,Waltham,MA)通过随机引物合成互补DNA,起始量为1.0μgRNA。
对于细菌的mRNA表达分析,从可用于SFB的功能基因序列设计qPCR引物(表S1)。基于与宿主的潜在相互作用和Th17细胞诱导选择靶向SFB功能的基因(Pamp等人,2012)。使用Primer Express版本2.0的默认参数如前所述(Stedtfeld等人,2008)设计引物。
使用具有SFB特异性16S rRNA基因和功能基因引物的定制SmartChip TM(Wafergen Biosystems,Fremont,CA)进行QPCR(表S1)。简而言之,Wafergen的定制SmartChip™阵列允许518个qPCR反应,100 nl体积并行运行。使用多样品纳米分配器(Wafergen Biosystems,Fremont,CA)将样品和引物分配到SmartChip TM中。如前所述进行PCR循环条件和初始数据处理(Wang等人2014 ; Stedtfeld等人2016)。SmartChip™上的扩增反应由1×LightCycler480SYBR®GreenI Master Mix(Roche Inc.,USA),无核酸酶PCR级水,qPCR反应中每个样品10 ng /μlcDNA模板组成(0.5 ng /反应孔)和0.5μM的每种正向和反向引物。每个反应一式三份进行测试,并且还进行无模板对照。如前所述计算每个反应的平均基因组拷贝(Looft等人,2012)。在每个样品中仅在三个技术重复中的一个中检测到的基因被认为是假阳性并且从分析中过滤。
对于16S rRNA基因序列分析,使用Power Soil Extraction试剂盒(MoBio)从回肠组织和内容物中提取群落DNA。如前所述制备细菌16S V4高变区的扩增子测序文库(Kozich等人,2013)。PCR后,使用Invitrogen SequalPrep DNA标准化平板将反应输出标准化并合并。使用Qubit dsDNA HS,Caliper LabChipGX HS DNA和Kapa Illumina文库定量qPCR测定的组合对文库进行定量。将该池加载到Illumina MiSeq v2标准流动池上用于测序,其以2×250bp配对末端形式与v2,500循环试剂盒一起进行。将特异于V4区域的测序引物(515f / 806r)添加到试剂盒的适当孔中,如(Kozich等人,2013)中所述。)。基本调用由Illumina实时分析(RTA)v1.18.64完成,RTA的输出被解复用并用Illumina Bcl2fastq v1.8.4转换为FastQ格式。将原始序列读数提交给NCBI(BioProject Accession No.PRJNA381198)。使用Qiime的默认参数分析序列(Caporaso等人,2010)。结构转变的分析是在家庭层面进行的。使用相同的测序深度(每个样品6472个序列)计算Chao和Shannon多样性指数。
基于用于提取RNA和提取/消化产率的组织质量和含量,分析QPCR的绝对丰度。SFB功能基因的表达分析包括归一化至SFB特异性16S rRNA基因引物组(计算相对表达)并检查施用10μg/ kg TCDD与玉米油(CO_10TCDD)和所有其他组之间的倍数变化的分析。使用Q = 1%的ROUT方法来识别和去除异常值(Motulsky和Brown 2006)。进行单向ANOVA和多重比较Sidak测试以比较具有幼稚对照的所有组并将10μg/ kg CO-TCDD组与不含TCDD的CO组和10μg/ kg AC-TCDD组进行比较。仅比较两组,双尾不成对t使用了测试。使用Prism(Windows版本7,GraphPad Software,San Diego,CA,USA)生成所有统计分析和一些图。火山地块是用Excel制作的。如果倍数变化> | 1.5 |,则认为大量的变化显着不同 并且p <0.05。
与初始对照相比,ATCDD引发的宿主反应显着影响了仅给予10μg/ kg CO-TCDD的组中SFB的绝对丰度(图1a)。在任何剂量的AC-TCDD中均未观察到TCDD诱导的SFB反应。总体而言,与未接受过TCDD的CO和10μg/ kg AC-TCDD组相比,在给予10μg/ kg CO-TCDD的组中观察到高出5.0倍,8.5倍和3.7倍的SFB水平,分别。10μg/ kg AC-TCDD和AC对照(倍数变化= 0.92)和幼稚组之间没有可测量的差异(倍数变化= 2.28,p = 0.98)。在重复实验中观察到类似的结果,其中仅在接受最高剂量的CO-TCDD的组中观察到SFB的显着增加(图S2)。)。与先前描述的研究一致,在AC上施用的TCDD消除了小鼠中的毒性反应(Boyd等人2017)和随后对肠道微生物组的关键成员的影响。然而,SFB未观察到先前用宿主生物测定法观察到的浓度依赖性剂量反应。
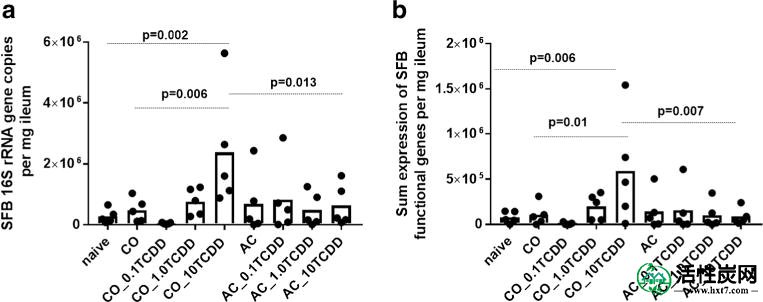
响应于0,0.1%,1.0或10微克/千克TCDD从回肠组织SFB基因表达的QPCR分析用玉米油载体(CO_TCDD)给药或吸附到活性炭(AC_TCDD):一个 SFB特异性16S rRNA基因的表达引物组和b表达SFB功能基因(n = 21个引物组)。从ANOVA中列出p值,其中在幼稚,CO与没有TCDD(CO)之间进行多重平均比较Sidak测试,在AC上施用10μg/ kg TCDD(AC_10TCDD)与在CO上施用10μg/ kg TCDD(CO_10TCDD)。数字0.1,1.0和10表示每千克剂量TCDD的微克数
为了进一步验证仅在给予CO的组中TCDD诱导的SFB生态失调,还通过qPCR分析回肠组织中选择的功能基因的表达。选择用于分析的功能性SFB基因包括推定宿主相互作用的因子(Pamp等人,2012)。用10μg/ kg CO-TCDD检测的功能基因数量(检测到的基因数为11.8±6.2)高于其他组(检测到4.3±4.0个基因数)。对于10μg/ kg CO-TCDD组小鼠,所有测试的功能基因的总和表达也显着更高(图1b)。施用AC-TCDD的所有组均未显示SFB功能基因表达的显着增加。
与所有其他组相比,10μg/ kg CO-TCDD组中功能基因(标准化为SFB特异性16S rRNA基因)的相对表达倾向于降低(图2a)。然而,这仅在推定的D-ala-D-ala-dipeptidase基因中显着(图2b),并且在推定的纤连蛋白结合蛋白中倾向于更低(p = 0.06)。仅对在给定组内的大多数重复中检测到的基因进行相对表达分析; 因此,只显示了11个基因(图2a)。检测到的所有基因的平均表达显示,虽然在给予10μg/ kg CO-TCDD的组中SFB 16S rRNA基因增加,但是功能基因之间的表达水平不同(图S3)。)。总之,SFB功能基因的表达进一步证实了当吸附到AC上时TCDD不具有生物可利用性。
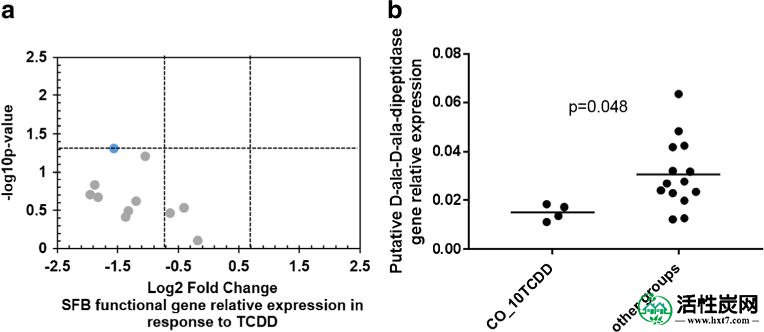
QPCR分析SFB功能基因在回肠中的相对表达。一个表示-Log火山图10 p值和Log 2倍数变化比较10微克/千克TCDD给药组的相对起作用的基因表达与施用玉米油(CO_10TCDD)与所有其它基团和b推定d的相对表达-ala-D-ala二肽酶基因。将功能基因相对表达标准化为SFB特异性16S rRNA基因
对16S rRNA基因进行测序以检查AC和CO对回肠中肠道微生物群的影响。结果显示AC显着增加了回肠中乳杆菌科的数量(图3b)。两个单独的细菌群在响应显著下降到AC包括Ruminococcaceae和Rikenellaceae(图3c,d)。还检查了Chao和Shannon多样性指数,并且由于AC,CO或TCDD没有观察到多样性的显着变化(图S4)。虽然Shannon多样性指数倾向于低于AC给药组,但这并不显着(p = 0.114)。
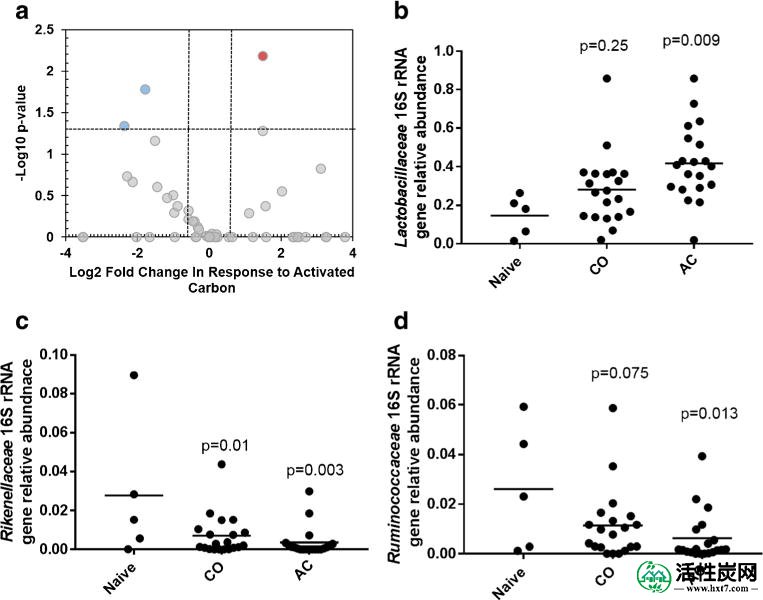
使用从回肠中提取的DNA比较幼稚小鼠与给予玉米油(CO)或给予活性炭(AC)的组的16S rRNA基因序列分析。一个表示-Log火山图10 p值和Log 2对于被分类在与AC给药天真的小鼠和小鼠之间的家庭级细菌序列变化倍数b - ð与AC显著影响该分类的家族
CO是在小鼠研究中施用TCDD和其他AhR配体的常用载体(Fernandez-Salguero等人,1996 ; Bruner-Tran和Osteen,2011),也影响肠道微生物群(图S5b),但程度低于之前的程度。用芝麻油观察。详细地说,在给予CO的小鼠中,只有三种细菌家族,包括甲烷嗜血杆菌,丹毒科和来自梭状芽孢杆菌的组显着减少(p <0.05)。在我们之前的研究中使用芝麻油 - 一种常见的载体(Brown et al.1998 ; Kopec)等人,2008),我们观察到,在移位SFB,方面相对TCDD的响应厚壁菌门和肠杆菌科(Bhaduri 2015 ; Stedtfeld等2017,提交)。例如,与给药前1天的相对丰度相比,初始剂量的芝麻油分别在粪便颗粒中的肠杆菌科减少~10倍和300倍,3天和7天。然而,与初始给药后5天测量的回肠或粪便颗粒中的幼稚对照相比,肠杆菌科不受CO影响(图S6)。总的来说,与芝麻油相比,CO可能是更合适的载体,用于研究宿主毒性和肠道调节与持久性有机污染物的影响。
选择SFB作为标记因为它与宿主免疫相互作用(Ivanov等人2009)并且在鼠模型中响应TCDD(Stedtfeld等人2017 ; Bhaduri 2015)。先前的研究已经推测在肠道微生物,包括SFB这种转变,是免疫系统的TCDD诱导的调制的间接响应(Zhang等人2015年。 ; Lefever等人2016。 ; Stedtfeld等人2017年。)。实际上,用抗羊红细胞免疫球蛋白M抗体形成细胞评估TCDD对这些小鼠免疫功能的影响,在剂量低至0.1μg/ kg CO-TCDD时诱导显着抑制体液活性(Boyd等。 2017年)。在小鼠粪便中测量,先前的研究还发现,粘膜免疫维持者缺乏的小鼠显示出SFB丰度增加10倍(Upadhyay等人,2012)。此外,体外研究还表明,TCDD并不直接影响肠道共生(Lefever等,2016 ; Stedtfeld等,2017)。总之,这些结果进一步证实细菌生态失调是由于TCDD诱导的宿主变化。如果生态失调是TCDD诱导的宿主腔内代谢物变化或免疫抑制的结果,则需要进行额外的分析来区分。
与CO相比,具有10μg/ kg CO-TCDD的SFB的数量显着更高仅在RNA中观察到而在DNA中未观察到。通过用DNA进行16S rRNA基因测序来测量,SFB仅响应于TCDD倾向于更高(倍数变化= 2.2,p = 0.15)。其他细菌群(例如,肠杆菌 ; 图S6)也如先前研究中所述(Ttedtfeld等人2017,提交; Lefever等人2016)对TCDD作出反应。小于10μg/ kg TCDD的剂量在此研究中没有显着影响SFB,这在之前已被观察到(Bhaduri 2015 ; Fader等2015))。详细地,先前观察到TCDD剂量的SFB丰度的显着变化,其中每4天施用1至30μg/ kg,持续28天(Bhaduri 2015)。我们怀疑与先前的研究(28至90天)相比,该实验的持续时间较短,影响了整体细菌反应。假设小鼠的TCDD半衰期为11天(Gasiewicz等,1983 ; Birnbaum,1986),理论分析显示两个实验的小鼠TCDD水平在测量时相似,但暴露持续时间不同。 (图S7)。如前所述(Boyd等人2017年),由于准确测量本研究中使用的低水平暴露的挑战,未确定鼠肠道粪便中TCDD浓度的分析测定; 使用AC进一步复杂化。
以前的研究测试AC作为猪抗生素的替代品,也通过培养分析观察到更高水平的乳酸菌数量(Chu等人,2013)。Chu和共同作者的研究还观察到大肠杆菌和乳酸水平显着降低。通常,由于有机酸的产生,乳酸菌被认为是益生菌,提供抑制病原生物的酸性环境。因此,短期摄入AC似乎不会对肠道微生物组的结构产生威胁性影响。
该研究的结果支持AC的补救性使用以使TCDD诱导的对小鼠宿主的肠道微生物组的反应静音。详细地,SFB功能基因仅用施用CO的最高剂量的TCDD表达。这最可能是由于如先前所证明的由AC隔离而消除宿主的生物利用度(Boyd等人2017)。通过对回肠内容物的16S rRNA基因分析测量,AC对肠道群落结构和多样性的影响最小。三名成员与AC显着转移,包括乳杆菌科的轻微增加,通常被认为是益生菌。与先前使用的芝麻油载体相比,CO载体在较小程度上影响肠道微生物群。总体而言,当在AC上施用TCDD时,肠道微生物组的关键成员的反应不存在。