发布日期:2018-11-07 11:29 来源:活性炭网 作者:活性炭网 浏览数:
抽象 植物 - 食草动物的相互作用受宿主植物质量的影响,而植物的生长条件又受其影响。 竞争是主要的生物和营养可用性,是植物生长环境中的主要非生物成分。 然而,令人惊讶的是
了解昆虫食草动物与寄主植物之间生态相互作用的潜在机制长期以来一直是生态学的重要目标[1]。影响这些相互作用的关键因素是寄主植物质量[2]。植物质量,定义为一般术语,包括与其食草动物相关的植物的所有物理,化学或生物学特性(例如大小和结构,物候,次生化合物和营养状况)。植物品质的变化会影响食草动植物的相互作用[1],[3] - [5],从而影响食草动物的生长,繁殖力和生存[4],[6] - [9]。由于食草动物本身会影响植物的生长,因此植物与食草动物的适应性不仅会受到受精或植物 - 植物竞争等因素的影响,还会受到这些生长条件对食草动物的影响以及由此产生的草食动物反馈影响。厂。为了直接区分间接影响,研究生长条件对植物和食草动物表现的影响的研究应该明确地解决这些反馈效应,例如通过在相同条件下饲养有和没有食草动物的植物。
营养素可用性是植物生长环境中的主要非生物成分。增加营养物质的可获得性,例如通过施肥,增加植物生长并影响植物质量[1],[6]。调查宿主植物养分有效性对昆虫食草动物影响的大多数研究都集中在受精的影响[6],[10],[11]。一般来说,肥料的施用预计会增加以植物为食的食草动物的丰度,因为较高浓度的初级代谢物[12]或植物抗草食动物防御的减少[13]将导致植物营养品质的提高。在大多数研究中,由于昆虫摄食偏好和食物消耗的变化,施肥确实增加了昆虫的丰度,导致开发时间缩短,存活率更高,繁殖力更高[6],[9],[10],[14],[15]。然而,有一些报道称,由于植物生理学在高肥料水平下的不利变化,施肥对草食动物的性能没有影响[16]甚至是负面影响[17]。此外,土壤肥力可能与植物生长环境中的其他因素相互作用,例如竞争对手或食草动物的存在,这使得预测肥料添加如何影响植物和食草动物的表现成为一项挑战。
限制植物资源可用性的主要生物因素之一是竞争[18],[19]。遭受竞争的个体通常表现出养分吸收,生长速度,存活率和繁殖力的降低。竞争中植物营养质量的下降也会降低食草动物的摄食性能[20]。与未受影响的邻居相比,草食动物通常会降低受攻击植物的竞争能力[21],但它们对植物竞争力的影响可能取决于竞争植物物种的特性,非生物条件以及食草动物损害的类型,强度和时间[22]。。一些实验发现,专业食草动物的攻击没有[23],甚至对植物竞争能力产生积极影响[24]。例如,当进料上的蚜虫早熟禾草,竞争的通过在地上和地下杂类的影响早熟生物量分别降低与没有蚜虫侵染上的情况相比,早熟 [20] 。尽管许多研究调查了食草动物和竞争对植物性能的影响[22] - [25],但人们对植物 - 植物竞争如何与食草动物对植物的影响相互作用缺乏了解。
植物之间的一种竞争模式是将化感物质(毒性代谢物)释放到环境中[26]。这种通常在入侵物种中发现的化感植物可能对竞争对手的种子萌发,生长或其他适应性参数产生强烈影响[27] - [30]。例如,据报道,黄花菜(加拿大一枝黄花)的根系分泌物和根提取物对邻近植物的生长具有抑制作用[31],[32]。为了将化感作用的负面影响与两种同时发生的物种之间的资源竞争分离,各种研究使用活性炭(AC)[30],[31],[33]。AC可以通过吸附,机械过滤,离子交换或表面氧化来中和土壤中的大量有机化合物[34],[35]。
在这项研究中,我们研究了植物生长条件的变化对植物和食草动物性能的直接和间接影响,使用专门的蚜虫Macrosiphoniella tanacetaria对其寄主植物Tanacetum vulgare,tansy和植物竞争者加拿大一枝黄花(Solidago canadensis),goldenrod,作为模型系统。为了控制植物生长条件,艾菊植物受精并与黄菊一起生长。重要的是,所使用的蚜虫不以黄花菜为食,因此竞争对寄主植物的影响并未因为草食动物的额外宿主的提供而混淆。我们添加了一种AC处理方法,将黄花菜的其他竞争效应与艾菊分离,并测量了寄主植物和食草动物对受控生长条件的反应。
我们有以下假设(H1-H4):H1-受精将通过增加植物生物量和蚜虫数量来增加植物(H1a)和蚜虫(H1b)的表现。H2 - 添加AC将在化感植物竞争者的存在下增加植物(H2a)和蚜虫(H2b)的性能,因为它从竞争中释放宿主植物。H3:植物 - 植物竞争将降低宿主植物(H3a)和食草动物(H3b)的表现。H4:对植物的食草作用取决于寄主植物生长条件。
艾菊蚜虫(Macrosiphoniella tanacetaria)((Kaltenbach),半翅目:蚜科(Aphididae))是艾菊的专业食草动物。该物种产生有性和无性变体(holocyclic)并且在艾菊(Tanacetum vulgare,L。Asteraceae)上花费其完整的生命周期。蚜虫不是蚂蚁[36]并且主要在枝条的尖端以松散的群体为食。
Tansy是一种多年生草本植物,原产于欧洲和亚洲,已被引入美国和澳大利亚[37]。自然栖息地可以在西伯利亚和欧洲的亚高山山区河谷中找到。今天,艾菊在河岸,荒地,路边,农村和城市工业区都很常见[38]。Tansy在全球范围内拥有超过23种蚜虫[39],[40]其中M. tanacetaria是最丰富的蚜虫之一[41]。
Goldenrod(加拿大一枝黄花(Solidago canadensis),菊科(L. Asteraceae))原产于北美洲,已成为欧洲最具侵略性的入侵者之一,与艾菊相同[38]。两种植物的大小相当。有证据表明黄菊花对共生植物具有化感作用[31],[42]。对于M. tanacetaria,yellowrod不是合适的寄主植物。
在全因子实验设计中,肥料处理(三个层次:对照,无机肥(F inorg),无机和有机肥(F inorg + org))与AC处理(两个层次:有和没有AC)交叉,植物竞争处理(两个级别:有和没有黄菊的竞争)和蚜虫处理(两个级别:有和没有蚜虫),导致3×2×2×2 = 24处理组合。
该实验在温室中的1升罐(11×11×12cm)中进行。作为土壤,我们使用在耶拿实验维护期间挖掘出的田间土壤,并将其作为堆放在现场(耶拿,图林根,德国; 50°55'N,11°35'E)由耶拿实验室管理(Anne Ebeling,弗里德里希 - 席勒大学,耶拿)。对于F inorg处理,将土壤与每罐1g Osmocote(Hermann Meyer KG,Rellingen,Germany)混合,缓释NPK肥料。对于F inorg +组织处理后,将土壤与含有有机腐殖质(1:1)的未经消毒的商业泥炭土混合,并加入1g Osmocote。在AC处理中,按照Abhilasha等人的推荐,加入8g细磨AC,粒径<0.8mm(Carl Roth Gmbh&Co.KG,Karlsruhe,Germany)。[31]。我们将每个处理组合复制5次,总共产生2×2×3×2×5 = 120盆。每组重复形成5个区块中的一个。本研究不需要许可证。该研究不涉及濒危或受保护物种。
2010年在德国耶拿市周围从天然存在的艾菊和黄花植物收集的种子。将来自约50个不同植物个体的种子混合,并从该混合物中随机抽取种子。为了种植这些植物,2011年5月将大约20粒艾菊和/或黄菊子种子直接播种到实验盆中并保持在受控的温室条件下(白天温度为〜25°C,夜间温度为~20°C;光照条件; 16小时光照:8小时黑暗)。植物在前两周内萌发,之后将来自每个物种的最强个体保持在盆中并且去除其余的植物,从而产生具有单一艾菊植物的盆和具有一个艾菊和一个黄花植物的盆。
8月,当植物长达3个月时,蚜虫处理的植物被从田间采集的5只未成熟的成虫蚜虫侵染。三天后取出成年雌性,让10只若虫生长并繁殖两周。为了避免通过逃逸蚜虫在植物之间发生交叉感染,所有盆(有和没有蚜虫)都覆盖有透气性的穿孔(<1mm)聚乙烯袋(20×35cm),用聚酯袋固定在带有松紧带的盆上。这种透明的覆盖物允许对植物上的蚜虫进行视觉评估而不会干扰它们。在实验开始后两周,计数蚜虫数,除去蚜虫,收获植物的地上部分,在70℃下干燥至恒定质量48小时,并称重。
对于植物生物量,我们计算了对数响应比(植物生物量LogRR),通过计算肥料,竞争和AC处理的每个特定组合,植物生物量的对数,直接量化蚜虫侵染对植物生长的影响。蚜虫除以没有蚜虫的植物的生物量。植物生物量LogRR <0的值表明没有蚜虫的植物的生物量高于具有蚜虫的植物的生物量,因此蚜虫的存在降低了植物生物量。相反,LogRR值> 0表明蚜虫的存在增加了植物生物量。
此外,我们计算了蚜虫负荷作为每单位(g)植物生物量的蚜虫数量[43],以比较生长条件对蚜虫相对于它们对植物的影响的影响。
线性混合效应模型用于分析处理对植物生物量的影响。所有处理,即蚜虫,肥料,AC和竞争处理及其相互作用都作为固定因子拟合在模型中。以类似的方式分析蚜虫数量。在该模型中,未被蚜虫感染但暴露于相同区块中的相同其他处理的植物的生物量被用作协变量,因为该生物量不与减少植物生物量的蚜虫效应混淆。此外,通过拟合肥料,AC和竞争处理及其相互作用,在类似模型中分析植物生物量LogRR和蚜虫负荷。所有模型都包含块作为随机因子,并使用R软件的2.14.1版本在nlme软件包[44]中使用函数“lme”进行估算[45]。必要时对变量进行对数转换(表1中所示)。在所有分析中,在模型简化期间(表1中给出的最小重要性的顺序)去除了非重要项。所有数据均表示为平均值±标准误差(SE)。使用额外的线性回归分析植物生物量(有或没有蚜虫)和蚜虫数量对所得植物生物量LogRR的影响。这些模型我们使用“lm”功能和所有其他处理(肥料,AC,竞争)的组合植物。
| 治疗 | 艾菊生物量* N = 120 | 植物生物量LogRR N = 60 | 蚜虫数* N = 60 | 蚜虫负荷* N = 60 |
| AP / TB° | F 2,101 = 87.0; p << 0.001 | - | F 1,42 = 426; p << 0.001 | - |
| 肥料 | F 2,101 = 812; p << 0.001 | F 2,52 = 0.28; p = 0.759 | F 2,42 = 16.8; p << 0.001 | F 2,49 = 83.4; p << 0.001 |
| AC | F 2,101 = 31.3; p << 0.001 | F 1,52 = 2.73; p = 0.104 | F 1,42 = 12.0; p = 0.001 | F 1,49 = 0.53; p = 0.470 |
| 竞争 | F 2,101 = 44.1; p << 0.001 | F 1,52 = 9.04; p = 0.004 | ˚F 1,42 = 0.64; p = 0.428 | (F 1,48 = 0.40; p = 0.527)4 |
| AP / TB×肥料 | F 2,101 = 0.20; p = 0.817 | - | F 2,42 = 3.18; p = 0.051 | - |
| AP / TB×AC | F 1,101 = 2.52; p = 0.115 | - | ˚F 1,42 = 51.1; p << 0.001 | - |
| 化肥×AC | F 2,101 = 51.7; p << 0.001 | F 2,52 = 9.66; p = 0.001 | ˚F 2,42 = 6.98; p = 0.002 | F 2,49 = 45.7; p << 0.001 |
| AP / TB×竞争 | F 1,101 = 7.54; p = 0.007 | - | (F 1,41 = 0.05; p = 0.826)7 | - |
| 化肥×大赛 | (F 2,99 = 1.61; p = 0.205)6 | (F 2,50 = 0.25; p = 0.782)3 | F 2,42 = 3.77; p = 0.031 | (F 2,46 = 2.08; p = 0.136)3 |
| AC×大赛 | (F 1,98 = 0.94; p = 0.334)5 | (F 1,47 = 0.44; p = 0.510)2 | (F 1,40 = 0.80; p = 0.376)6 | (F 1,45 = 0.64; p = 0.426)2 |
| AP / TB×肥料×AC | F 2,101 = 7.89; p = 0.001 | - | (F 2,36 = 0.18; p = 0.838)4 | - |
| AP / TB×肥料×竞争 | (F 2,96 = 0.22; p = 0.806)4 | - | (F 2,34 = 0.84 p = 0.439)3 | - |
| AP / TB×AC×大赛 | (F 1,95 = 0.38; p = 0.539)3 | - | (F 1,33 = 0.11; p = 0.738)2 | - |
| 化肥×AC×大赛 | (F 2,93 = 2.18; p = 0.118)2 | (F 2,47 = 0.42; p = 0.658)1 | (F 2,38 = 1.67; p = 0.207)5 | (F 2,43 = 1.22; p = 0.304)1 |
| AP / TB×肥料×AC×大赛 | (F 2,91 = 0.35; p = 0.704)1 | - | (F 2,31 = 2.05; p = 0.145)1 | - |
与未感染的对照植物相比,蚜虫的感染显着降低了艾菊生物量(表1,图1A)。因此,平均植物生物量LogRR强烈为负(表1,图1B)。另外的分析表明,植物生物量LogRR与艾菊植物的生物量无关,即蚜虫对植物的影响不仅仅是寄主植物大小的函数:植物实验结束时的生物量都没有( F 1,57 = 2.28; p = 0.136)也没有没有蚜虫的植物(F 1,57 = 2.304; p = 0.134)解释了观察到的植物生物量LogRR的变化。相反,植物生物量LogRR随着蚜虫数量的增加而下降(F 1,57 = 3.97; p = 0.05; 图2)。因此,蚜虫对艾菊植物生物量的影响随着蚜虫群体的大小而增加。在实验结束时,任何处理中的植物都没有开花。
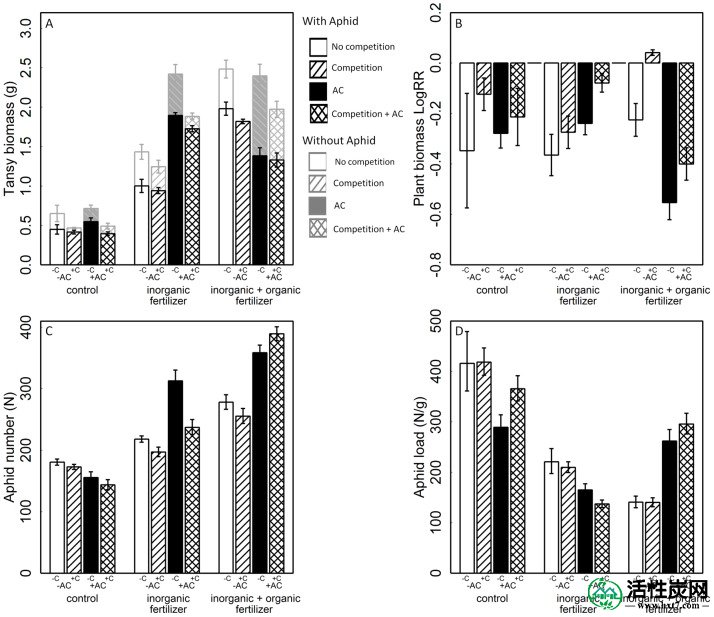
在实验处理中操纵艾菊生长条件,三种水平的肥料与两种活性炭(AC)杂交,竞争和蚜虫侵染(Macrosiphoniella tanacetaria))。我们将每个处理组合复制5次,总共产生2×2×3×2×5 = 120盆。(A)艾菊生物量,(B)植物生物量对数响应比(植物生物量LogRR),即用蚜虫侵染的植物的生物量除以经受相同施肥,AC和竞争处理的对照植物的生物量,(C)蚜虫数, (D)蚜虫负荷(每单位植物生物量的蚜虫数)。条形图表示蚜虫处理(黑条:蚜虫,灰条:无蚜虫),条形图表示AC处理(+ AC:黑色和阴影柱; -AC:白色和倾斜柱)和竞争处理(含比赛(+ C):孵化和倾斜,没有比赛(-C):白色和黑色的柱子)。显示均值±SE。有关统计测试,请参阅表1。
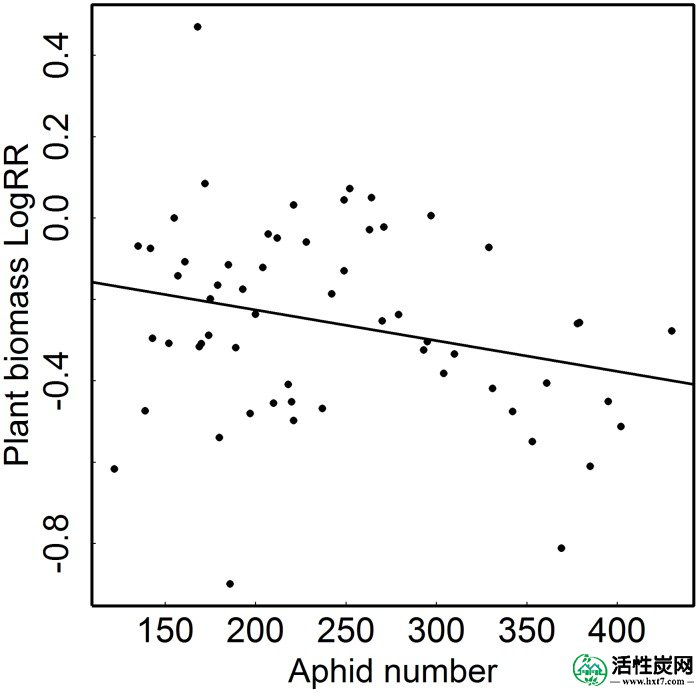
在蚜虫(Macrosiphoniella tanacetaria)存在下,艾菊植物生物量LogRR被测量为艾菊生物量除以对照植物生物量。该分析结合了实验中施加的所有其他处理的宿主植物。
根据H1a,施肥显着增加了艾菊生物量(表1)。具体地,与未处理的对照植物相比,添加F inorg或F inorg + org使艾菊生物量增加两倍(图1A)。
AC添加的结果与预期的不同:向土壤中添加AC通常增加艾菊生物量,但与H2a相比,这种效果与菊科植物的存在无关。相反,AC的作用取决于肥料和蚜虫的处理。添加AC对对照土壤没有影响,但添加F inorg时增加了艾菊生物量。在没有蚜虫和蚜虫存在的情况下减少生物量的情况下,将AC与F inorg + org一起添加不会增加艾菊生物量(表1,图1A)可能是该处理组合中蚜虫数量最高的结果(表1),图1A)。正如当与F中的土壤中加入AC因此,植物生物质LogRR是更负inorg +组织在添加只是的F相比inorg(表1,图1B)。
菊科植物的存在减少了艾菊生物量,证实了H3a(表1,图1A),特别是对于没有蚜虫的植物。通过竞争减少艾菊生物量在蚜虫侵染的植物中减少(表1,图1A)。因此,植物生物量LogRR对艾菊植物的负面影响小于没有竞争的情况(表1,图1B,图S1)。
蚜虫感染降低了植物性能,较大的菌落对艾菊生物量产生了更多的负面影响。正如预期的那样,肥料增加和竞争减少了艾菊生物量,并且在食草动物存在的情况下竞争的负面影响较小。与我们的期望相反,没有证据表明黄菊的化感作用。AC增加艾菊的表现,与潜在的化感竞争者的存在无关。
以蚜虫数量测量的蚜虫性能随着植物生物量的增加而增加(表1,图3)并且取决于植物生长条件,如下所述。蚜虫负荷,即蚜虫数量和植物生物量的比率,因此取决于生长条件对蚜虫性能(见下文)和植物性能(见上文)的影响。
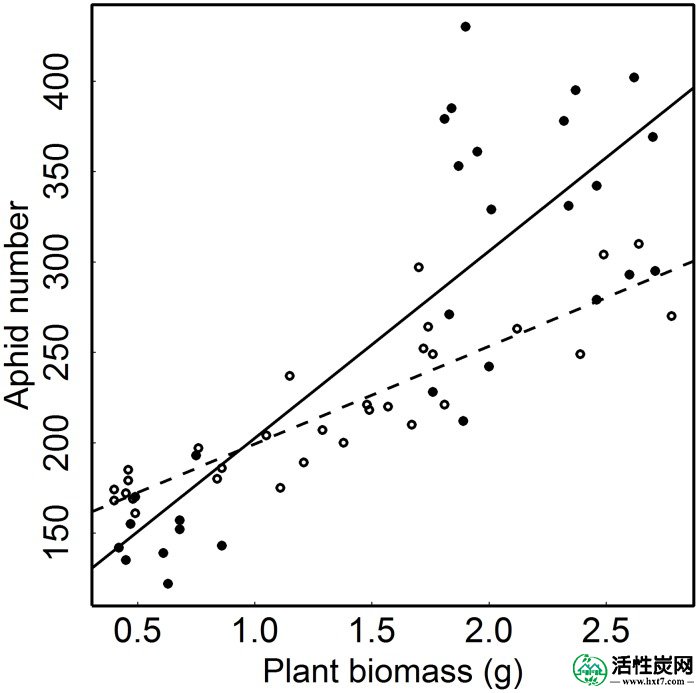
空心圆圈和虚线表示没有活性炭的土壤中艾菊植物上的Macrosiphoniella tanacetaria蚜虫的数量。闭环和实线是用活性炭处理的土壤中植物上的蚜虫数。未用蚜虫感染但暴露于相同其他处理的对照植物的生物量被用作解释变量,因为该生物量代表植物的潜在大小而没有由于蚜虫感染而减少植物大小。
如H1b中预测的那样,添加肥料增加了蚜虫数量(表1,图1C,D)。有趣的是,仅添加F inorg使蚜虫数量增加到中等水平,而在土壤中添加F inorg + org使蚜虫数量比对照增加了约两倍。虽然蚜虫和植物生物量的数量随着施肥而增加,但植物的响应更强,因此受精植物的蚜虫负荷低于对照植物(表1,图1)。
向土壤中添加AC往往会增加蚜虫数量,与H2b相比,这种效应与菊苣的存在无关(表1)。AC的作用再次依赖于肥料处理。在对照土壤中,AC降低了蚜虫数量,而在两种肥料处理中,AC增加的蚜虫数量在与F inorg + org的组合中最高(表1,图1C))。因此,蚜虫数量对受精和AC的响应强度不同于植物生物量对相同处理的响应,这反映在处理如何影响蚜虫负荷。一般来说,施肥导致蚜虫负荷减少,因为植物生物量的增加强于蚜虫数量的增加(图1A,C)。对于具有F inorg的对照土壤和土壤,这是正确的,其中,添加AC降低了蚜虫负荷(表1,图1D)。相比之下,AC + F inorg + org处理的植物生物量不高于AC + F inorg处理,而蚜虫数量在AC + F inorg + org处理中最高(图 1A,C)因此,当两种肥料与AC一起加入时,蚜虫负荷高于仅加入F inorg + org时的蚜虫负荷。
因此,AC的添加也影响了蚜虫数量和植物生物量之间的关系(表1)。AC数和植物生物量之间的正相关在AC存在下比在没有AC时更强(图3)。
对于与菊科植物竞争的艾菊植物,蚜虫数量一般低于没有竞争的植物,正如H3b所预测的那样,只有当F inorg + org和AC加入土壤时蚜虫数量在竞争中增加(表1),图1C)。因此,与假设H3b相反,植物 - 植物竞争并不是简单地减少蚜虫数量,而是蚜虫数量对竞争的反应取决于与肥料的相互作用。蚜虫负荷不受竞争处理的显着影响(表1,图1D)。
正如预期的那样,肥料增加,竞争减少了蚜虫数量。与预期相反,AC增加了蚜虫数量,而与潜在的化感竞争者无关。蚜虫负荷量化了蚜虫相对于植物生物量的数量,取决于对蚜虫和植物性能的影响程度。因此,蚜虫对植物性能的影响与确认H4的植物生长条件相互作用。
我们的研究结果表明,寄主植物生长条件影响艾菊和以蚜虫为食的专门蚜虫食草动物的表现。受精增加了植物和蚜虫的表现,竞争减少了艾菊生物量和蚜虫数量,分别证实了我们的第一和第三个假设。在存在和不存在潜在的化感竞争者的情况下,AC增加了植物和蚜虫的表现,因此与假设2相反,没有迹象表明黄菊通过化感物质竞争。相反,通过增加植物和蚜虫的性能,AC的添加更像是额外的肥料。正如假设4所预测的那样,食草动物对植物的影响取决于寄主植物的生长条件,因为它的大小,部分也是对肥料反应的方向,AC和竞争处理在植物和食草动物之间不同。由于我们的全因子设计,特别是在相同条件下饲养有和没有食草动物的植物,分析食草动物对植物的反馈效应作为不同处理的函数是可能的。
资源可用性和资源质量,例如N含量可能对食草动物具有不同且独立的影响[46]。在我们的实验中,我们专门操纵植物质量,受精对蚜虫的影响是由于宿主植物质量的变化,而不是宿主植物生物量,由于各种原因。首先,蚜虫的总数总是相对较小,即使当蚜虫种群数量达到最大值430个体时,只有一小部分蚜虫被蚜虫覆盖。其次,尽管蚜虫对植物生长有明显的不利影响,但没有明显的损害迹象,并且没有观察到蚜虫在植物上行走寻找觅食地点。第三,也是最重要的是,蚜虫对艾菊植物生物量的影响与植物生物量无关。
正如预期的那样,两种肥料处理都增加了艾菊生物量。施肥还提高了研究蚜虫的性能; 这些结果与先前的研究结果一致,这些研究表明施氮增加了蚜虫物种的种群增长[47] - [49]。这些结果具有直接的田间相关性,因为M. tanacetaria田间的蚜虫密度在施肥时比在较少受精的植物上高[36]。克莱恩和穆勒[13]受精艾菊,发现C:N比例下降,即受精艾菊植物可获得更多的氮,因此受精植物的蚜虫表现增加可能是植物养分水平增加的结果[3],[47 ] ],[49]。蚜虫对植物质量的这种差异做出反应,正如Nowak和Komor [50]的实验室实验所表明的那样,他们发现M. tanacetaria更容易沉淀并开始以更高的氨基酸浓度在韧皮部汁液中进食,并随着增加而增加施肥。除了宿主营养状况的增加,受精还可能影响宿主质量的其他方面:例如Kleine和Muller[13]发现施肥艾菊植物显示较低水平的萜类防御化学物质。
虽然肥料对植物和蚜虫表现的积极影响并不令人惊讶,并且与我们的假设H1一致,但是蚜虫对植物的反馈效果并不像预期的那样简单,因为施肥影响的方式存在细微差别。植物和蚜虫。为了解施肥对植物 - 蚜虫相互作用的影响,我们首先计算了蚜虫负荷,量化蚜虫相对于植物性能的表现。在我们的实验中,植物生物量和施肥的蚜虫数量的增加不成比例,即每增加一个单位植物生物量少于一个额外的蚜虫单位。因此,尽管蚜虫的绝对数量低于施肥处理,但对照土壤中生长的植物的蚜虫负荷最高。蚜虫负荷随着寄主植物生物量的增加而下降,导致最大的植物显示出最大的蚜虫数量,但不是最高的蚜虫负荷。有机肥进一步使问题复杂化:用F处理蚜虫负荷较高inorg + org比仅用F inorg治疗。这是因为除了F inorg之外还添加F org时,艾菊的生物量没有进一步增加,如没有蚜虫的植物所示。相反,在蚜虫处理中,即使在最高水平,蚜虫的数量也对肥料水平的增加产生积极反应。
反馈效应的第二个衡量指标是植物生物量LogRR,它测量了肥料,AC和竞争处理的所有组合对蚜虫造成的植物生物量的减少。虽然蚜虫负荷是衡量草食动物对植物潜在影响的指标,但LogRR直接量化了这种影响。因为蚜虫减少了植物的生物量,正如其他研究[51] - [54]所发现的那样。,植物生物量LogRR总是负的,随着蚜虫数量的增加而增加。虽然蚜虫的负荷随着肥料的添加而增加,但是通过积累更多的生物量,艾菊植物显然从营养物可获得性的增加中获益更多,因为它们的蚜虫数量较多,导致植物生物量LogRR较低。例外情况是营养水平最高,其中蚜虫数量甚至更高,对艾菊生物量产生更强的负面影响,导致植物生物量LogRR降低。通常,蚜虫负荷和植物生物量LogRR的模式是相反的,表明为了理解食草动物对植物的反馈效应,有必要计算两者。
我们的研究结果强调植物 - 食草动物相互作用的微妙之处,这取决于植物和食草动物可以利用植物养分供应增加的确切方式。受精对植物和食草动物都有益,并且一些受精似乎比植物更有益于植物,因此受精减少了食草动物对植物的影响。然而,我们的研究结果表明,在一定程度的受精过程中,主要是草食动物受益,因此营养素的任何额外增加都将有助于食草动物种群的积累,而不是进一步使宿主受益。对于所有植物 - 食草动物系统而言可能不是这种情况,并且如果发生这种影响,则取决于具体的相互作用,在不同的营养物可用水平下。在农业系统中,
正如预期的那样,与我们的假设H3一致,与没有竞争对照的对照植物相比,在有和没有蚜虫的两种处理中,与菊科植物竞争的艾菊植物都较小。这很可能是限制土壤养分供应的竞争结果[55]。虽然不能完全排除地上对光的竞争,但艾菊植物通常比黄花更高(艾菊高度平均值为35.94±0.98厘米,黄花高度平均值分别为31.13±1.18厘米),这使得菊花不太可能通过阴影影响艾菊。
植物 - 植物竞争也对蚜虫食草动物(H3)产生负面影响,因为在竞争中艾菊植物的蚜虫数量通常较低。Schädler等人记录了在宿主植物竞争者存在下类似的蚜虫表现降低。[20],他们讨论了含氮化合物质量(而不是数量)的差异,作为降低食草动物性能的机制,因为在N固定竞争者存在的情况下蚜虫数量的减少比在另一个存在时减少。福布[20]。
以前的研究通过在黄花根或叶提取物存在下发现潜在植物竞争者的发芽减少来证明黄菊的化感潜力[31],[42],这是我们AC治疗的主要动机。但是,我们没有找到任何关于化感作用的证据; 加入AC并没有减轻竞争的影响。这个结果有几种可能的解释。除了我们的研究与之前的研究之间的实验差异[31],[42],黄芪的化感作用可能仅限于种子萌发或幼苗建立。这种解释符合对Pisula和Meiners的研究[42]他们在莴苣(Lactuca sativa L.)和萝卜(Raphanus sativus L.)的萌发论文中发现了黄菊的化感作用的证据,但在研究具有高密度黄菊的老田地的演替动态时没有观察到任何化感作用。虽然AC治疗并没有降低我们研究中的竞争效果,但它确实表明了AC之前已经描述的潜在副作用[34],[56],[57]。在AC处理中观察到的植物和蚜虫表现的增加与观察到AC的添加可以充当肥料[34],[56]。当AC和死有机物质都添加到土壤中时,AC和有机肥之间也存在相互作用,指向复杂的土壤过程。这种不明确的相互作用可能是意想不到的影响,例如当F inorg + org和AC加入土壤时植物 - 植物竞争下蚜虫数量的增加。
草药和竞争预计会对焦点植物产生负面影响[21],[23],但它们也可能起拮抗作用[22],[25]。例如,Haag等人。[25]发现当食草动物影响社区内的所有植物时,食草和种间植物竞争的影响可能是对抗性的。此外,Schädler等人。[20]进行了类似于我们的实验,其中食草动物局限于焦点植物,使用Poa上的谷类蚜虫作为一个模型系统。他们发现,当食草植物仅限于重点植物时,只要种间植物竞争减少了重点植物上食草动物的种群增长,竞争和食草动物就会产生拮抗作用[20]。。在我们的研究中,竞争对艾菊生物量的影响在缺乏时比在蚜虫存在时更强,换句话说,植物生物量LogRR对艾菊植物在竞争中的负面影响较小。这表明与没有竞争的植物相比,蚜虫对竞争中的植物的影响较小。这种效应很可能是由于竞争减少了艾菊植物上的蚜虫数量,从而减少了对艾菊植物的竞争的负面影响。结果,没有竞争的植物的生物量通过较大的蚜虫集落比竞争中的植物的生物量更强烈地减少,其被较小的集落感染。
我们的温室研究结果与了解野外条件下植物食草动物的相互作用有关。在非农业系统中,蚜虫群体大多数很小,只有少数非常大,每株植物有数百到数千个个体[58],[59]。因此,在自然条件下,主要是资源质量而非资源数量限制了蚜虫种群的增长。限制野外群体大小的另一个关键因素是大型捕食者组织的捕食[60]。虽然我们的研究没有考虑植物生长条件如何影响较高的营养水平及其对食草动物(可能还有植物)的反馈影响,但这种相互作用也会受到资源可用性的影响。[61]。由于田间捕食率高,蚜虫群体的生长关键取决于受寄主植物生长条件影响的繁殖与捕食造成的死亡率之间的平衡。因此,由于植物 - 植物竞争导致的对蚜虫生长速率的任何小的负面影响,以及由于土壤中较高的养分可用性而对生长速率的每一个积极影响,都可能严重影响当地蚜虫的持久性。对蚜虫种群动态的这种小规模影响尚未得到充分研究[36]。蚜虫是特殊的食草动物,因为它们每年产生许多代,并且可能迅速积累大量种群。因此,寄主植物生长条件的影响对于蚜虫尤其明显。然而,寄主植物的竞争态势和养分有效性的空间变化通常会造成植物和食草动物的局部生长速率的变化,并且这种空间异质性已被证明对植物 - 食草动物系统以及捕食者的动态具有动态后果。和寄生蜂以食草动物为食[62]。
我们的研究发现植物和草食动物的生长以及草食动物对植物的反馈效应受到非生物和生物植物生长条件的影响,在我们的受精和植物植物竞争中。虽然生长条件对植物生物量和蚜虫数量的影响通常相互反映,但我们的结果强调了植物 - 食草动物相互作用的变化,这取决于植物和食草动物可以利用植物养分有效性的增加和对竞争反应的确切方式。 。施肥有益于植物和食草动物。然而,我们的研究结果表明,在一定程度的受精过程中,主要是其他草食动物的植物受益于额外的营养。因此,即使绝对蚜虫数量增加,受精下的蚜虫影响也会减少。因此,食草动物感染的生态成本取决于生长条件对植物和食草动物表现的影响的平衡。当所有合作伙伴对植物生长条件中的操作的响应分别针对每个合作伙伴的孤立及其相互作用进行研究时,可以获得对反馈效应的机制洞察。